Введение и приложения
В приложениях флуоресцентной микроскопии часто применяются различные способы ограничения области возбуждения флуорофоров и области их свечения до тонкого слоя в образце. Снижение фоновой флуоресценции из областей вне фокальной плоскости может значительно улучшить отношение сигнал-шум и, следовательно, пространственное разрешение деталей и событий, представляющих интерес. Во флуоресцентной микроскопии полного внутреннего отражения (TIRF — TIRFM) используются уникальные свойства индуцированной быстрозатухающей волны или поля в ограниченной области образца, непосредственно прилегающей к границе раздела двух сред с разными показателями преломления. На практике, в приложениях TIRF-микроскопии, границей раздела чаще всего оказывается область контакта образца с покровным стеклом или контейнером с тканевой культурой.
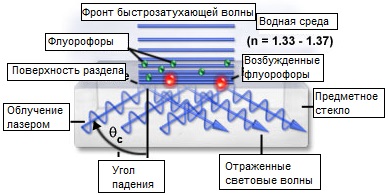
Рис. 1. Флуоресценция полного внутреннего отражения
Понятия, лежащие в основе TIRF-микроскопии не новы, и значительный интерес к этому методу и энтузиазм вокруг него объясняются технологическими достижениями, облегчающими его применение. Доступность полностью готовой к использованию измерительной аппаратуры, где применяется этот метод, а также развитие технологии флуорофоров, как например генетическое кодирование флуоресцентных образцов, дало возможность исследовать множество процессов на клеточных мембранах и других поверхностях, которые раньше были недоступны.
Физическое обоснование TIRF-микроскопии
Физическое явление полного внутреннего отражения (ПВО) лежит в основе таких, казалось бы, совершенно далеких друг от друга приложений, как волоконно-оптическая передача данных и древние приемы гранильщиков алмазов для усиления сверкания, или «огня», драгоценных камней. Каждый раз, когда луч падает на границу двух сред с различными показателями преломления (n), в результате рефракции (или отклонения) луча происходит его частичное или полное удержание в среде с большим показателем. При распространении коллимированного светового пучка в одной среде и достижения им границы раздела, он, в зависимости от угла падения и разницы показателей преломления двух сред, либо преломляется, при входе во вторую среду, либо отражается от границы раздела обратно. Полное внутреннее отражение возможно лишь в ситуациях с более низким показателем преломления второй среды. Такое преломление определяется законом Снеллиуса:
n(1) • sinθ(1) = n(2) • sinθ(2)
где n(1) больший, а n(2) меньший показатель преломления среды. Угол между падающим лучом и нормалью к поверхности обозначен как θ(1), а угол преломленного луча соответственно — θ(2). При падении луча на поверхность раздела двух сред под достаточно большим углом, называемым критическим углом (θ(с)), он преломляется параллельно поверхности раздела (90 градусов к нормали), а при больших углах он полностью отражается обратно в первую среду.
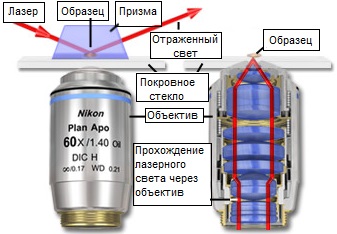
Рис. 2. Освещение образца при TIRF-микроскопии
Хотя при углах падения, больших критического, луч и не проникает во вторую среду (с меньшим показателем преломления), отраженный свет генерирует в ней электромагнитное поле, ограниченное областью, непосредственно примыкающей к границе раздела. Частота этого нераспространяющегося (или быстрозатухающего) поля совпадает с частотой падающего света, а поскольку оно затухает экспоненциально с увеличением расстояния от границы раздела, глубина его проникновения в образец в z направлении (перпендикулярно поверхности) составляет не больше нескольких сотен нанометров. В типичном эксперименте флуорофоры, расположенные вблизи границы стекло-жидкость или пластик- жидкость, могут быть возбуждены нераспространяющимся полем при условии наличия у них потенциальных электронных переходов в полосе (или вблизи нее) длин волн освещающего пучка. Из-за экспоненциального характера затухания интенсивности нераспространяющегося поля, возбуждение флуорофоров обычно ограничено областью толщиной менее 100 нанометров. Для сравнения, толщина такого оптического среза составляет примерно одну десятую от получаемой методами конфокальной флуоресцентной микроскопии. Поскольку возбуждения флуорофоров всего образца не происходит, вторичная флуоресценция ограничена очень тонким участком, что по сравнению с традиционным широкопольным эпифлуоресцентным освещением значительно улучшает отношение сигнал-шум. Этот усиленный сигнал позволяет, методом TIRF-микроскопии, зарегистрировать флуоресцентное свечение единичных молекул.
Основная концепция флуоресценции полного внутреннего отражения проиллюстрирована на рисунке 1, где на предметном стекле микроскопа находятся клетки образца, содержащие флуоресцентные молекулы (зеленые флуорофоры на рисунке). Показатели преломления предметного стекла (1,518) и водной среды образца (приблизительно 1,35) подходят для обеспечения полного внутреннего отражения вовнутрь предметного стекла. Задание значения угла падения возбуждающего лазерного луча большего, чем критический угол, приводит к полному обратному отражению светового пучка от границы раздела; при этом в области образца, непосредственно прилегающей к этой границе, генерируется нераспространяющееся поле. Флуорофоры, расположенные ближе всего к поверхности стекла выборочно возбуждаются при взаимодействии с нераспространяющимся полем, и вторичная флуоресценция от этих излучателей собирается оптикой микроскопа.
Как отмечалось выше, направление распространения световых пучков после падения света на границу раздела двух сред, а именно угол отражения или преломления, зависит от угла падения и от соотношения показателей преломления этих сред. Критический угол падения, за которым наступает полное внутреннее отражение, может быть рассчитан по закону Снеллиуса, приведенному выше. Применительно к типичному для биологии исследованию процессов на клеточной мембране, n(1) в этом уравнении представляет показатель преломления предметного стекла (приблизительно 1.5), в то время как n(2) относится к водному буферу или компонентам цитоплазмы (от 1.33 до 1.38). Когда n(1) больше n(2), а угол θ(1) превышает критическое значение θ(с), в стекле происходит полное внутреннее отражение. Когда угол падения больше критического, преломление происходит под углом 90 градусов (sin q(2) = 1), и закон Снеллиуса сводится к следующему уравнению:
n(1) • sinθ(с) = n(2)
или
sinθ(с) = n(2)/n(1)
поэтому критический угол может быть выражен как:
θ(с) = sin-1n(2)/n(1)
Полное внутреннее отражение не возникает случайно при достижении критического угла, но появляется в результате постепенного изменения соотношения «преломление-отражение» от преобладающего преломления до полного отражения, при превышении критического угла. С приближением угла падения к критическому значению, интенсивность проходящего (преломленного) пучка падает, а отраженный пучок усиливается. При всех углах падения, больших критического значения, происходит полное внутреннее отражение, при котором практически весь свет отражается обратно в первую среду. Хотя свет в такой ситуации не распространяется во второй среде, малое количество отраженного света проникает через границу раздела, распространяясь при этом параллельно ей и, создавая в непосредственно прилегающей к ней области во второй среде электромагнитное поле. Это поле называется нераспространяющимся, и, в непосредственной близости к поверхности раздела, оно способно возбуждать флуорофоры. Расстояние, на котором возможно возбуждение, ограничено экспоненциальным затуханием энергии затухающей волны в направлении z (перпендикулярном поверхности раздела). Следующее уравнение определяет эту энергию, как функцию расстояния от поверхности раздела:
E(z) = E(0)exp(-z/d)
где E(z) — это энергия на расстоянии z от поверхности раздела, а E(0) — энергия на самой поверхности раздела. Глубина проникновения (d) зависит от длины волны падающего света (l(i)) и угла падения, а также от показателей преломления граничащих сред. Эта зависимость выражена уравнением:
d = λ(i)/4π • (n(1)2sin2θ(1) — n(2)2)-½
При малых углах падения, распространение световых волн через поверхность раздела в среду с низким показателем преломления носит синусоидальный характер и имеет соответствующий период. Приближение угла падения к критическому значению приводит к увеличению периода преломленных лучей, при этом направление их распространения становится почти параллельным поверхности раздела. При достижении критического угла период волны становится бесконечным, а волновой фронт преломленного света становится перпендикулярным поверхности раздела.
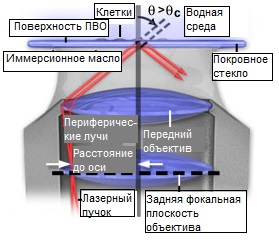
Рис. 3. TIRF-Объектив с высокой числовой апертурой
Подытоживая сказанное, можно отметить несколько факторов, существенных при использовании затухающей волны в микроскопии. Для возникновения полного внутреннего отражения и генерирования нераспространяющегося поля, показатель преломления среды, из которой свет падает на границу раздела, должен быть больше показателя преломления среды образца (n(1) больше, чем n(2)), а угол падения (θ(1)) должен быть больше критического угла (θ (с)). От длины волны падающего света зависит как глубина проникновения затухающей волны, так и факт возбуждения флуорофоров, которые флуоресцируют лишь, когда их характеристики поглощения соответствуют длинам волн источника света. Зависимость от длины затухающей волны в сочетании с экспоненциальным затуханием ее энергии в направлении z приводит к тому, что становится возможным возбуждение точно заданного флуоресцентного свечения в очень тонком оптическом срезе, толщиной менее 100 нанометров. Хотя TIRF-микроскопия ограничена лишь наблюдением явлений на поверхностях раздела двух сред с соответствующими показателями преломления, большое число приложений идеально подходят для применения этого метода. Одной из основных областей исследования является биомедицина, в которой процессы, проливающие свет на трудноразрешимые вопросы, протекают на поверхностях клеток или плазматических мембран — границах раздела, подходящих для исследования с помощью TIRF-микроскопии.
Основы инструментального подхода к TIRF-микроскопии
Существует два основных подхода к выбору конфигурации измерительной аппаратуры для флуоресцентной микроскопии полного внутреннего отражения: метод с использованием призм, и метод с использованием объективов. На рисунке 2 представлены эти две основные конфигурации. В конфигурации с призмой, сфокусированный лазерный луч попадает на покровное стекло в микроскопе, пройдя через призму, закрепленную на его поверхности; при этом угол падения устанавливается близким к критическому (см. рисунок 2(а)). Применение призмы для наведения осветительного пучка имеет несколько ограничений, в основном геометрического характера, связанных с манипуляцией образцом, и, хотя этот метод применяется в биологии уже более двух десятилетий, он никогда не был основным инструментом исследования. Существует много различных конфигураций, использующих призмы, но большинство из них ограничивают доступ к образцу, делая затруднительными любые манипуляции с ним, введение инъекций или выполнение физиологических измерений.
Другой недостаток призменного метода проявляется при использовании для исследований инвертированных микроскопов, когда образец освещается со стороны, противоположной объективу; при этом область с нераспространяющимся полем должна наблюдаться через толщу всего образца. Чтобы избежать этого, призму можно переместить на сторону образца, обращенную к объективу, но это создает дополнительные проблемы из-за близости объективов с короткими рабочими расстояниями к образцу и самой призме. Сложность и точность, требуемые при конфигурировании систем, основанных на эффекте полного внутреннего отражения, отбивали охоту у многих исследователей, пока производители микроскопов не предложили полностью готовые (под ключ) системы. А те из них, кто хотел использовать этот метод, вынуждены были разрабатывать и собирать свои собственные системы. Эта трудность, в сочетании с необходимостью настройки и обслуживания открытого лазера на оптической скамье, означала, что ранние исследователи, использующие призменный метод, были скорее физиками, чем биологами.
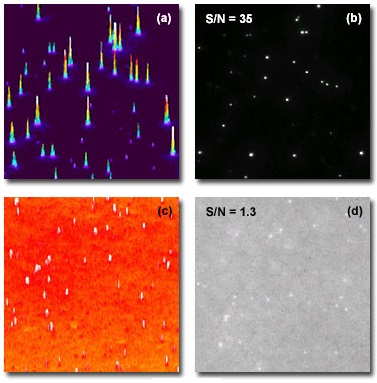
Рис. 4. Микросферы во флуоресценции ПВО и широкопольной флуоресценции
Метод, основанный на использовании объектива, иногда называемый сквозным методом освещения через объектив под заданным углом падения, свободен от многих ограничений, характерных для призменного метода (см. рисунок 2(b)). В этом методе для наведения света (когерентного лазерного или некогерентного от дуговой лампы) на границу раздела покровное стекло — образец используется объектив. Углы падения больше критического достигаются использованием объективов высокой числовой апертуры (в идеале 1,45 и выше). Обычно под числовой апертурой понимается светосила объектива, его способность фокусировать лучи. Но с другой стороны, она определяет диапазон углов, под которыми свет выходит из объектива, когда объектив используется для фокусировки света. Соотношение между числовой апертурой и достижимым углом падения света описывается следующим уравнением:
Числовая апертура (NA) = n • sin(θ)
где NA — числовая апертура объектива, n — показатель преломления, а q — половина угловой апертуры объектива. Объединение этого соотношения с приведенным выше условием полного внутреннего отражения приводит к следующему результату: полное внутреннее отражение при наблюдении живых клеток с обычным для них показателем преломления 1,38 возможно при их освещении через объектив с числовой апертурой большей 1,38. Для того чтобы быть полностью отраженным на границе образец — стекло, свет должен пройти через апертурный конус объектива с числовой апертурой больше, чем 1,38. При освещении когерентным лазерным лучом луч должен быть сфокусирован на периферии задней апертуры объектива, чтобы угол его выхода через переднюю оптическую поверхность был равным критическому значению или больше него. В случае некогерентного освещения, как например освещения от дуговой лампы, на оптическом пути должна быть поставлена маска в форме непрозрачного диска для того, чтобы свет мог попадать на объектив только через периферийную часть задней апертуры.
Ограничение области освещения в задней фокальной плоскости объектива внешним кольцом обеспечивает блокировку лучей центрального осветительного конуса, которые обычно выходят из объектива под углами, меньше критического. В результате облучение, идущее от объектива, представляет собой полый конус света, падающий на поверхность ПВО под углом, вдвое меньше необходимого для полного внутреннего отражения. Если значительная доля освещения проходит через центральную часть задней апертуры объектива (область более низкой числовой апертуры), то вместо полного внутреннего отражения происходит эпи-освещение, понижающее отношение сигнал-шум в плоскости изображения. На практике непрозрачный светоблокирующий диск может быть помещен на подвижную заслонку, позволяющую быстро переключаться между режимами TIRF (ФПВО) и эпи-освещения.
Возбуждение нераспространяющегося поля с помощью светосильных объективов дает большую гибкость в манипуляциях с образцом и используемых способах измерений, по сравнению с призменным методом, но требует более строгого контроля выставления угла падения, которое в этом случае представляет более сложную задачу. При использовании лазера, угол падения света, проходящего через призму, можно легко менять в широком диапазоне, тем самым непосредственно контролируя глубину проникновения нераспространяющегося поля. В системе освещения через объектив, лазерный луч фокусируется в задней фокальной плоскости объектива вне оси (преимущественно во внешних областях апертуры), при этом увеличение расстояния от оси объектива приводит к соответствующему возрастанию угла падения света на образец (см. рисунок 3).
Если числовая апертура объектива достаточно высока, достигается критический угол, необходимый для полного внутреннего отражения. Поскольку основной клеточный компонент (цитозоль) имеет показатель преломления 1,38, числовая апертура объектива должна превышать это значение. С числовой апертурой 1,4 всего несколько процентов периферийной области объектива могут быть использованы для полного внутреннего отражения, а критический угол может быть превышен лишь ненамного, что делает весьма затруднительным сопряжение лазерного луча с задней апертурой объектива. Очевидно, объективы с более высокой числовой апертурой имеют преимущество, поскольку обеспечивают дополнительный рабочий диапазон для тонкой регулировки углов падения, превышающих критический. При превышении критического угла дальнейшее увеличение радиального расстояния между лазерной фокальной точкой и осью объектива приводит к плавному и воспроизводимому уменьшению глубины проникновения нераспространяющегося поля.
Приложения TIRF-микроскопии
В общем, освещение с полным внутренним отражением имеет потенциальные преимущества в любом приложении, где требуется визуализация мелких структур или единичных молекул в образцах с большим количеством флуорофоров, расположенных вне представляющей интерес оптической плоскости, таких как молекулы в растворах с броуновским движением, пузырьки, подвергающиеся эндоцитозу или экзоцитозу, или перенос отдельных белков в клетках. За счет ограничения (уменьшения) толщины области возбуждения при наблюдении таких образцов обычно сильно возрастает отношение сигнал-шум. На рисунке 4 представлены снимки раствора с флуоресцентными микросферами, полученные методами TIRF (рисунок 4(b)) и традиционного эпифлуоресцентного освещения (рисунок 4(d)). Слева от каждого снимка приведена соответствующая ему гистограмма интенсивности (рисунки 4(a) и 4(с)). Высокая четкость изображения микросфер, достигнутая благодаря повышению отношения сигнал-шум (С/Ш) с 1,3 до 35, очевидна на этих снимках; а на гистограмме, относящейся к TIRF, видна четкая локализация и высокая интенсивность сигнала (рисунок 4(a)).
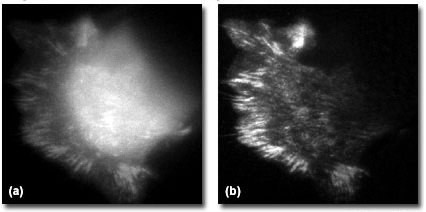
Рис. 5. Фокальная адгезия клеток в широкопольной флуоресценции и TIRF
Уже давно было понято, что TIRF-микроскопия могла бы стать мощным инструментом в решении многих биологических вопросов, но хотя эта методика применяется уже более 20 лет, до недавнего времени ей не уделялось должного внимания. Контакты типа клетка-субстрат фибробластов человеческой кожи, помеченных флуоресцентными липидами, были исследованы методом TIRF-микроскопии в ранних 1980-х. Приблизительно в то же самое время методами TIRF-микроскопии в сочетании с методом восстановления флуоресценции после фотообесцвечивания (FRAP) были проведены исследования биомолекулярной поверхностной динамики, а также переноса энергии в бычьем сывороточном альбумине, связанном на поверхностях. В более поздних исследованиях, методика TIRF была объединена с резонансным переносом энергии флуоресценции (FRET) — другим методом, получившим быстрое развитие и применение во многих областях исследований.
Тенденция ко все большему использованию TIRF-микроскопии и других передовых технологий во многом обязана появлению и возрастающей доступности современной модульной аппаратуры, избавляющей от необходимости проектировать и строить по индивидуальному заказу измерительные системы, предназначенные для каждого отдельного исследования. Другим важным фактором является развитие многостороннего и универсального биологического инструментария, применимого к широкому кругу проблем, наиболее важным из которого является использование зеленого флуоресцентного белка (GFP) и его голубой, синей, желтой и красной разновидностей. GFP, полученный из медузы, не требует для флуоресцентного свечения видо-зависимых кофактров и может быть использован в экспериментах независимо от вида. Этот биологический флуорофор был введен в сотни белков методом генетической рекомбинации, и его потенциал в этом отношении поистине безграничен. Другое перспективное направление обещает развитие GFP-мутантов, которые выступают в роли индикаторов внутриклеточного кальция в процессе высвобождения секреции нейромедиаторов. Эти белки наблюдались в некоторых исследованиях методом резонансного переноса энергии флуоресценции.
TIRF-микроскопия является идеальным методом исследования, как механизмов, так и динамики многих белков, вовлеченных в межклеточные взаимодействия. На рисунке 5 представлены сравнительные снимки живых клеток (PtK1 эпителиальные клетки печени кенгуру, экспрессирующие GFP-винкулин) с использованием традиционного широкопольного эпифлуоресцентного метода (рисунок 5(a)) и освещения быстрозатухающей волной (рисунок 5(b)). На снимке, полученном при исследовании методом TIRF, ясно видна локализация гибридного белка в фокальной адгезии клеток на поверхности субстрата, в противоположность расплывчатому, из-за фоновой флуоресценции, изображению, полученному при эпи-освещении. Наблюдение живых клеток является одним из наиболее обещающих приложений TIRF-микроскопии. Взаимодействие белков на поверхности клеточных мембран, как например участвующих в фокальной адгезии, имеет чрезвычайное значение в клеточной биологии. Понимание признаков нормального роста клеток и его замедления в результате межклеточных контактов (контактное торможение) может пролить свет на аномальный рост, возникающий при таких заболеваниях, как рак.
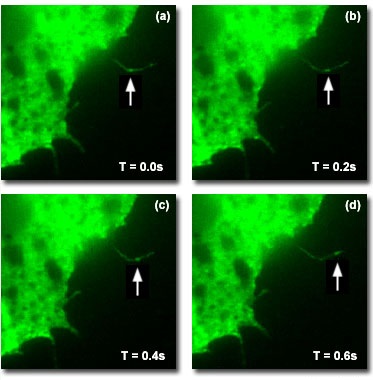
Рис. 6. Съемка динамики белка в заданный временной интервал
На биомолекулярном уровне методика TIRF применялась для визуализации единичных молекул белка мутанта GFP-Rac, переносимых вдоль тонких филоподий клеток, растущих на субстрате (рисунок 6). Этот белок влияет на подвижность клетки, поэтому для ее понимания чрезвычайно важно представлять динамику взаимодействий этого белка на клеточной мембране. Визуализация флуоресценции единичных молекул с достаточным для изучения их динамики разрешением по времени возможна с помощью TIRF-микроскопии благодаря необыкновенно высокому отношению сигнал-шум, достигаемому при облучении затухающей волной. На рисунке 6 представлены четыре последовательных во времени кадра, снятых с интервалом 200 миллисекунд. Они иллюстрируют движение молекулы гибридного белка GFP-Rac (стрелки) по тонкой филоподии клетки Xenopus, растущей на субстрате.
Хотя TIRF-микроскопия действительно ограничена исследованиями структур и процессов, происходящих на границе покровное стекло-образец, однако, неожиданным оказалось то, что многие насущные вопросы биологии и биомедицины могут быть исследованы на клеточной мембране. Нейробиология является той областью, в которой многие фундаментальные вопросы как раз подходят для исследования методами флуоресцентной микроскопии полного внутреннего отражения. Идеальным местом приложения этой методики стало изучение выделения и поглощения нейромедиаторов в синапсе. Исторически, механизмы мембранного переноса и слияния, включая выделение (экзоцитоз) и поглощение (эндоцитоз) синаптических везикул-пузырьков, исследовались генетическими, биохимическими методами и электронной микроскопией. Эти методы во многом опосредованы и дают одномоментное представление о происходящих процессах, будучи не в состоянии проследить сложную динамику функционирования клеточной мембраны.
Разработка метода фиксации потенциалов позволила, с помощью измерений емкостных сопротивлений, по чрезвычайно малым изменениям электрических характеристик, следить за увеличением или уменьшением поверхности мембраны или выделением окислительных веществ. Недостатком этой методики является то, что регистрируются лишь моменты слияния, и хотя необходимое разрешение по времени может быть достигнуто, тем не менее, не хватает информации о пространственной локализации представляющих интерес явлений. Поскольку все происходящие явления детектируются вместе, невозможно добиться специфики, а детализация на стадиях переноса везикул, стыковки и слияния мембран выводится путем объединения результатов измерения клетки и кинетического моделирования. Электронные микроскопы, хотя и дают исключительное пространственное разрешение, не позволяют наблюдать живые клетки и процессы в их динамике, а соотнесение одномоментных снимков с результатами других измерений весьма затруднительно. Преимущество метода TIRF, продемонстрированное в недавних исследованиях, состоит в возможности прямого визуального наблюдения динамических взаимодействий, белка-везикулы.
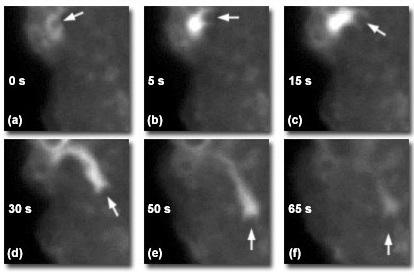
Рис. 7. Взаимодействие белка с везикулой, полученной методом TIRF-микроскопии
Благодаря способности оптически различать отдельные везикулы и непосредственно следить за динамикой их взаимодействий, TIRF-микроскопия предоставляет возможность изучать множество белков, участвующих в нейробиологических процессах, способом, казавшимся ранее невозможным. В недавних исследованиях удалось наблюдать выделение содержащих флуоресцентные липиды синаптических везикул из активных зон и последующую доставку пузырьков из резервного пула, расположенного в 20 нанометрах от плазматической мембраны, для восполнения уже использованных. Другое исследование заключалось в прямом наблюдении роли актинов в динамическом процессе эндоцитоза в культивируемых мастоцитах. Было видно, как филаменты GFP-актина, окружив флуоресцентно окрашенные пиноцитозные везикулы, заталкивали их в клетку, увлекая своим потоком. Последовательность TIRF снимков, полученная в заданный временной интервал, на рисунке 7 иллюстрирует динамику GFP-актина во время эндоцитоза. Шесть последовательных снимков сняты в различные моменты времени в интервале от 0 до 65 секунд. Белые стрелки указывают на свечение гибридного белка GFP-актина.
На рисунке 8 представлено цветное изображение, иллюстрирующее взаимодействие актина с везикулой-пузырьком во время эндоцитоза. На двухканальном снимке (рисунок 8(а)) видно, как поток GFP-актинов, окрашенных зеленым, окружает во внеклеточной среде везикулу, содержащую техасский красный декстран. Благодаря цейтраферной последовательности из трех двухканальных снимков (рисунки 8(b) — 8(d)) возникает понимание динамики взаимодействия актина с везикулой во время пиноцитоза. Логическим продолжением этого подхода может быть окрашивание нескольких синаптических белков с помощью различных цветовых вариантов GFP, для исследования их взаимодействия и динамики.
Хотя изображения, полученные с помощью TIRF-микроскопии, являются плоскими, существуют способы получения и трехмерной информации о расположениях везикул и клеточных структур, причем как в живых, так и в связанных образцах. На рисунке 9 представлены снимки структур в клетках с иммуноцитохимически окрашенным белком тубулина, выполненные с помощью широкопольноого эпифлуоресцентного освещения (рисунок 9(a)) и освещения быстрозатухающей волной (рисунок 9(b)). Структурные детали, не визуализированные при эпи-освещении, ясно видны на снимке, полученном с помощью TIRF. Разница двух режимов визуализации становится более очевидной при наложении снимков в псевдоцветах. На рисунке 9(с) эпифлуоресценции приписан зеленый цвет, а TIRF — красный.
Принципы TIRF-микроскопии предполагают, что меняя угол падения освещения, а следовательно и глубину проникновения затухающей волны, можно различать глубину флуорофоров с точностью до нанометров. Более точный контроль глубины проникновения легче осуществить в системах, использующих призму, эффективность которых была недавно усилена с помощью акустооптических дефлекторов (АОД), предназначенных для быстрой смены угла падения. Посредством быстрого изменения глубины проникновения нераспространяющегося поля можно отслеживать пузырьки и другие структуры на разных глубинах и точно определять их положение. Применение АОД в TIRF может быть эффективно во многих приложениях, как например, использование чрезвычайно быстрых затворов для своевременной модуляции длины волны освещения в системах с многоволновыми лазерами.
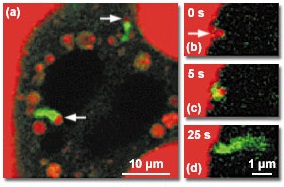
Рис. 8. Цветное изображение динамики везикула-актин
Как уже обсуждалось выше, изменение угла падения в системах, применяющих освещение через объектив, не так легко выполнимо, как в тех, которые используют для этой цели призму, хотя новейшие объективы с высокой числовой апертурой дают существенное улучшение в настройке угла падения. В общем, системы с освещением через объектив способны регистрировать большее количество испускаемого света, а интенсивность этого сигнала обратно пропорциональна увеличению расстояния. Это свойство дает дополнительное преимущество при калибровке TIRF систем, когда уровень флуоресцентного сигнала соотносится с положением оси, что может быть использовано при получении трехмерных изображений.
Перспективы развития
TIRF-микроскопия сегодня имеет прочную теоретическую базу, а практическое применение этой методики значительно упростилось благодаря недавним технологическим достижениям. Неудивительно, что она все чаще используются в биомолекуляных исследованиях и исследованиях в клеточной биологии. Конфигурация TIRF систем, основанных на прямых или инвертированных микроскопах относительно проста при использовании лазерного источника света, но может быть выполнена и с применением обычной дуговой лампы, при условии блокировки света, проходящего через центральную часть объектива. Сейчас доступны законченные модульные микроскопические системы, собранные для TIRF-микроскопии в сочетании с другими оптическими методиками, а некоторые производители выпускают объективы с высокой числовой апертурой, разработанные специально для приложений, использующих внутреннее отражение. Методика TIRF совместима с различными режимами освещения, включая светлопольное, темнопольное, фазовоконтрастное, дифференциальный интерференционный контраст и традиционную эпифлуоресценцию. Особенным преимуществом систем с освещением через объектив является их сочетаемость с различными механизмами манипуляций с биомолекулами, таких как атомно-силовая микроскопия. Вероятно, тенденция совмещения TIRF-микроскопии с другими дополнительными методиками сохранится и далее.
Получение изображения живых клеток с высоким временным разрешением на многих длинах волн является многообещающим направлением для TIRF-микроскопии, а всестороннее использование различных комбинаций красителей должно выявить такие детали клеточных процессов, которые были скрыты до сегодняшнего дня. Недавно исследователи заявили об обнаружении флуорофоров, испускающих свет на двух длинах волн, но возбуждаемых монохроматическим светом, что путем конфигурирования систем многоволнового возбуждения должно привести к дальнейшему расширению области приложений TIRF-микроскопии. Усовершенствование свойств красителей и характеристик детекторов послужит толчком в изучении единичных молекул. Распространение метода TIRF при изучении клетки, похоже, будет продолжаться за счет усовершенствования методик генетического и молекулярного манипулирования, объединенных с наблюдением сигналов высокого пространственно-временного разрешения, полученных в результате облучения затухающей волной.
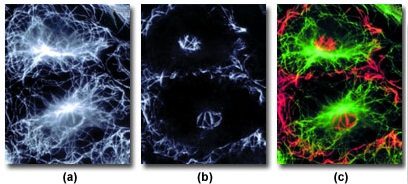
Рис. 9. Клеточная структура в широкопольном освещении и флуоресценции полного внутреннего отражения (TIRF)






.png)