Благодаря растущему числу исследований, использующих методы визуализации живых клеток, и стремительным успехам в области технологии флуоресцентных белков и синтетических флуорофоров, складывается принципиальное понимание природы функционирования клеток и тканей. По существу, визуализация живых клеток стала не только необходимым инструментом в большинстве биологических лабораторий, занимающихся изучением клеток, но и стандартной методикой, применяющейся в различных областях нейробиологии, биологии развития, фармакологии и других биомедицинских дисциплинах. Одной из наиболее существенных проблем при проведении экспериментов по визуализации живых клеток является поддержание на предметном столике микроскопа условий, благоприятных для нормального функционирования клеток и сохранения их в здоровом состоянии, в то время как они освещаются в присутствии синтетических флуорофоров и/или флуоресцентных белков.
Контроль температуры
При использовании любых систем, предназначенных для получения изображений живых клеток, могут возникнуть затруднения в том случае, когда эксперименты выполняются с препаратами, требующими температур, значительно отличающихся от температуры окружающей лабораторной среды (следует отметить, что флуктуации температуры при получении изображений живых клеток являются, скорее, правилом, чем исключением). Клеточные функции чрезвычайно чувствительны к колебаниям температуры, — изменение всего лишь на пару градусов оказывает сильное действие на клеточную физиологию. Существуют различные методы контроля температуры клеток на предметном столике микроскопа. Многие из описанных выше коммерческих систем оснащаются нагревателями, устанавливающимися непосредственно на камеру. Хотя такой подход обеспечивает простую интегрированную систему, функция контроля температуры, зачастую, ограничивается собственно камерой, и в расчет не принимаются сопутствующие элементы, которые могут негативно влиять на поддержание постоянной температуры. Одним из важнейших факторов, связанных с флуктуациями температуры, является то, что предметный столик, штатив и объективы микроскопа играют роль теплоотводящих элементов и противодействуют работе системы обогрева образца. Эта проблема усугубляется при использовании иммерсионных объективов, поскольку среда для оптического согласования, которой может быть масло, глицерин или вода, обладают намного большей, чем воздух, теплопроводностью. В том случае, когда температура объектива не контролируется, в условиях дополнительной и близко расположенной тепловой нагрузки, каковой являются высокоапертурные объективы, вся система может быстро отдавать тепло. Находящаяся непосредственно под объективом область описанных выше статических камер часто может быть на 5 градусов (Цельсия) холоднее остального пространства камеры с образцом.

Рис. 3. Конструкции обогревателей объективов для визуализации живых клеток
В зависимости от конфигурации, микроскоп можно целиком заключить в обогреваемый кожух. Однако, некоторые критические проблемы контроля температуры можно исключить за счет использования имеющихся на рынке обогревателей для объективов (см. рисунок 3), в которых используется циркулирующая горячая вода или резистивные нагревательные элементы. Будучи используемыми совместно с соответствующей системой обогрева образца, обогреватели для объективов могут частично компенсировать градиент температуры между образцом и передней линзой объектива. Отметим, однако, что даже при использовании обогревателя для объектива, вдоль тубуса объектива, а также между объективом и собственно микроскопом, все же существует некоторый градиент температуры. Показанные на рисунках 3(a) и 3(b), соответственно, регулируемые обогреватели типа «манжета с электрообогревом» и с циркулирующей водой, с термодинамической точки зрения одинаковы. Единственное их различие состоит в том, что в первом обогревателе (рисунок 3(a)) тепло создается за счет электричества, тогда как для второго (рисунок 3(b)) оно вырабатывается вне обогревателя и переносится в него жидкостью, циркулирующей в рубашке объектива. В обоих случаях теплообмен сравнительно неэффективен, поскольку большое количество тепла, вместо передачи в объектив, излучается в область, находящуюся непосредственно под образцом. В результате, избыточное внешнее тепло по конвективным каналам поднимается вверх, непосредственно к образцу, и создает большие колебания температуры и лишние рабочие циклы системы регулирования температуры в камере.
Тепловые профили объективов являются функциями их физических параметров. Предлагаемые на рынке объективы, в большинстве своем, предназначены для микроскопии неподвижных клеток (выполняющейся при комнатной температуре). Поэтому к выбору объектива следует отнестись очень внимательно, поскольку для получения изображений живых клеток подходят только те объективы, которые можно эффективно обогревать. Кроме проблемы обогрева объектива, в результате циклической работы системы регулирования температуры может измениться местоположение покровного стекла, в результате чего образец выйдет из фокуса. Кроме того, исследователь должен знать, что имевшие место сообщения о значительном сокращении срока службы объектива, и особенно в части внутренних деформаций элементов объективов, из-за его периодического нагревания и остывания, ошибочны. В действительности, нет достаточного количества достоверных доказательств влияния циклических изменений температуры на деформационные характеристики специализированных объективов, которые, в большинстве своем, могут безболезненно переносить температуры до 50 градусов Цельсия. Единственный негативный эффект, обусловленный обогревом объективов микроскопов, заключается в кратковременном увеличении вязкости смазки (которая достигает пластичности жевательной резинки) возвратного механизма объектива, в сравнении с объективами без обогрева. Однако, в случае иммерсионных обогреваемых объективов, склонность иммерсионного масла просачиваться в тубус часто продлевает срок службы исходных смазочных материалов.
Вокруг микроскопа стационарной системы можно установить большой бокс, обогреваемый теплым воздухом. В этом случае можно уравнять температуру практически всех деталей микроскопа, что позволяет исключить любые перемещения, обусловленные тепловым расширением этих деталей. Кроме того, можно минимизировать потоки воздуха вокруг камеры с образцом. К сожалению, кожух может ограничивать доступ к микроскопу и его регулируемым элементам. В связи с этим, может оказаться целесообразным изготовить бокс из сравнительно простых и недорогих деталей и материалов, на тот случай, если потребуется его существенно модернизировать.
Решающим фактором является строгий контроль температуры не только для микроскопа, но и во всем лабораторном помещении. Для изготовления современных микроскопов используется широкий спектр материалов, включая алюминий, пластмассы, композиты, стекло, латунь и сталь, — все эти материалы обладают разными коэффициентами теплового расширения. Изменение температуры всего лишь на один градус может привести к нежелательным перемещениям в оптической системе микроскопа, нарушив, тем самым, ее фокусировку или юстировку. Вокруг проходящих вблизи микроскопа воздуховодов системы кондиционирования или отопления часто возникают локальные флуктуации температуры, в конечном итоге, приводящие к проблемам с фокусировкой. Для длительных наблюдений многие исследователи устанавливают вокруг предметного столика термостатированный бокс (см. выше), или даже устанавливают весь микроскоп в помещение с температурой 37 градусов Цельсия (довольно некомфортные условия для работы). В конечном счете, верная методика определяется конкретным применением. Однако, при проектировании системы для визуализации изображений живых клеток, а также лаборатории, в которой эта система будет работать, совершенно необходимо принимать во внимание все описанные здесь аспекты.
Факторы лабораторных условий
Помещение для проведения экспериментов по получению изображений живых клеток должно быть оборудовано вентиляционной системой, способной эффективно удалять озон, образующийся при работе ртутных и ксеноновых дуговых ламп, а также пары органических растворителей, использующихся для чистки оптических поверхностей и дезинфекции предметного столика микроскопа. Вокруг микроскопа должно быть достаточно свободного пространства для вентиляции, а также мытья и чистки пола, стоек, столов и аппаратуры. Часто отказы оборудования происходят из-за засорения расположенных близко к полу или в недоступных местах вентиляционных отверстий (воздухозаборных каналов). В лаборатории необходимо поддерживать должную чистоту и порядок, а также минимизировать уровни содержания пыли, дыма и других вредных испарений, способных ухудшить характеристики оптических и электронных компонентов. С целью снижения риска загрязнения живой клеточной культуры микроорганизмами, необходимо регулярно протирать предметный столик микроскопа и окружающие участки 70-процентным этанолом (этиловым спиртом) или имеющимися в продаже антисептическими салфетками. Пролитую культуральную среду (неизбежное явление при манипуляциях в камере с живыми клетками) необходимо немедленно убрать, а залитый, и прилегающие к нему участки, тщательно продезинфицировать.
Среди источников механической вибрации, которая может повлиять на работу микроскопа, следует отметить расположенные на чердаке или на крыше здания системы центрального отопления и вентиляции (или кондиционирования), холодильники, низкотемпературные инкубаторы (даже в соседних помещениях), а также движение по близлежащим коридорам. Вибрации, создаваемые холодильными установками и другими источниками, могут не быть очевидными, но, при этом, существенно влиять на устойчивость микроскопа. Существуют различные методы снижения уровня низкочастотных вибраций, имеющих место в помещении или во всем здании, включая газонаполненные изолирующие столы с обратной связью (наиболее дорогой вариант) и сравнительно недорогие гибкие подушки из синтетических полимеров (см. рисунок 4). На рынке предлагаются подушки с различной геометрией и уровнями демпфирования, соответствующие широкому спектру конфигураций. Сочетание противовибрационных подушек с массивным, полудюймовой толщины листом алюминия, либо с перфорированной изоляционной платформой, часто позволяет снизить вибрации до незаметного уровня. Хотя, в сравнении с вертикальными микроскопами, штативы инвертированных микроскопов для наблюдения тканевых культур намного массивнее и менее чувствительны к вибрациям, все же, и для них виброизоляция весьма полезна. Уровень высокочастотных вибраций, во многих случаях, удается существенно снизить, поместив на стол дополнительную нагрузку, например, свинцовые бруски. И, наконец, при исследовании деталей, требующих сверхтонкого разрешения, могут потребоваться дополнительные меры, например, работа в ночное время или рано утром, когда окружающая среда более спокойна.

Рис. 4. Системы виброизоляции
Кроме вибраций, передающихся через пол, необходимо принимать в расчет потенциальные воздушные источники вибраций. Имеются сообщения о вибрационных помехах, создаваемых находящимися в лаборатории охлаждающими вентиляторами или вентиляторами кондиционеров, и даже шумами выхлопных систем проезжающих поблизости транспортных средств (такие шумы проводятся оконными стеклами), которым подвергается устойчивое в других отношениях оборудование для микроскопии высокого разрешения. Кроме того, аппаратура по получению изображений живых клеток может оказаться чувствительной к шумам охлаждающих вентиляторов лазерных установок и другого оборудования. В этом случае эффективным средством устранения вибраций может послужить отрезок гибкого воздуховода между охлаждающим вентилятором и излучателем (головкой) лазера. В системах с перфузионной и гравитационной подачей питающей среды периодические механические смещения могут возникать из-за вибраций, создаваемых пузырьками газа в питающем растворе, и достигающих камеры с образцом по трубопроводам. Акустические шумы также могут быть источником вибраций и ухудшать устойчивость микроскопа. Шумные вентиляторы необходимо заменить, а другое оборудование, склонное к созданию сильных шумовых помех (и, возможно, вибраций), следует, по возможности, перенести в другое помещение. Часто микроскопы оснащаются встроенными источниками света и силовыми трансформаторами, которые могут постепенно нагревать корпус микроскопа и приводить, тем самым, к медленному локальному смещению образца.
Еще одним, очень важным, аспектом и, возможно, одной из самых серьезных проблем, возникающих при получении последовательностей изображений живых клеток в течение заданных интервалов времени, является контроль температуры в помещении, где находится (устойчивый в других отношениях) микроскоп и сопутствующее оборудование. Установленный в тесном помещении с плохой вентиляцией, микроскоп может существенно повышать температуру окружающей среды. Тепловая нагрузка, создаваемая источниками света, регуляторами температуры, затворами, фотокамерами, компьютерами и прочим оборудованием, может превышать номинальные возможности помещения. В этом случае требуется дополнительная система охлаждения. Дополнительное охлаждение, при условии, что оно не является еще одним источником вибрации и пыли, облегчает режим работы электронного оборудования. При этом, мощность вентиляторов охлаждения компьютеров (и высокоскоростных жестких дисков) микроскопической системы может оказаться недостаточной, поскольку на шасси устанавливаются выделяющие тепло платы, например, контроллеры фотокамер, системы обработки изображений и дополнительная память. Проблемы проявляются в виде полного отказа системы, повышенного уровня шума и, в самом худшем случае, потери данных. Зачастую, решение проблемы охлаждения облегчается установкой в корпусе компьютера дополнительного малошумящего вентилятора.
Несмотря на то, что созданные в результате большого количества конструкторских работ по минимизации влияния источников вибрации, современные инвертированные микроскопы для наблюдения тканевых культур (наиболее удобные для визуализации изображений живых клеток) представляют собой надежные автономные приборы, дополнительное оборудование, зачастую, может нарушить присущую им устойчивость. В процессе работы системы, соединенные непосредственно с корпусом микроскопа, высокоскоростные затворы и диски со светофильтрами (смена оптических фильтров) создают значительные вибрации, длительностью от десятков до сотен миллисекунд. Кроме того, многие модели микроскопов исследовательского уровня содержат встроенные моторизированные элементы (револьверные держатели, механизмы фокусировки и т. д.), которые также могут быть источниками вибраций, если производитель не ограничивает скорость работы таких элементов и/или не вводит задержку между моментами срабатывания механизма и получения снимка. Влияние вибраций, создаваемых дополнительными устройствами, можно существенно уменьшить, либо вовсе устранить, за счет установки таких устройств на отдельных, независимых держателях (стойках, опорах и т. д.) рядом с микроскопом. На рынке имеются алюминиевые оптические лабораторные панели с готовыми крепежными отверстиями; эти панели идеально подходят для изготовления кожуха микроскопа и вспомогательных устройств.
Дрейф фокусировки
Одной из наиболее серьезных и часто встречающихся проблем, в микроскопии с получением изображений живых клеток в течение заданного интервала времени, являются флуктуации аксиального положения фокальной плоскости микроскопа. Часто называемое дрейфом фокусировки, изменение положения фокальной плоскости микроскопа обусловлено, обычно, колебаниями температуры в камере для образца или в помещении, где установлен микроскоп. Обобщенный качественный анализ взаимосвязи теплового состояния микроскопа и положения фокальной плоскости его объектива показывает, что изменение температуры на один градус Цельсия может вызвать смещение фокальной плоскости, приблизительно, на полмикрона (500 нанометров). Хотя, как правило, неровности поверхностей покровных стекол, а также механическая нестабильность, обусловленная проскальзыванием в редукторах, сжатие и усадка слоев смазки между подвижными деталями микроскопа, и не являются главным источником проблем, все же, могут вносить свой вклад в дрейф фокусировки. В отсутствие системы обратной связи для постоянного отслеживания и коррекции фокусировки, одним из наилучших способов является термостатированный бокс, в который полностью помещается микроскоп и все сопутствующие компоненты. Весьма несложно получать без дополнительного оборудования последовательности сфокусированных изображений в течение коротких промежутков времени. В то же время, многие долгосрочные эксперименты провалились из-за дрейфа фокусировки. Как правило, в большинстве случаев можно установить, что источником неудачи является тепловая неустойчивость, вызывающая деформацию покровного стекла или создающая перепады температур в оптической системе микроскопа.
Устранение дрейфа фокусировки следует считать принципиальным аспектом в процессе выбора конфигурации микроскопа для получения изображений в заданные промежутки времени. Особенно это касается объективов с высокой числовой апертурой, малая глубина резкости которых (около 300 нанометров) требует удерживать фокальную плоскость в пределах 100 нанометров от исходного положения. Прежде чем запустить последовательность получения изображений, всю систему, включая микроскоп, фотокамеру, затворы, диски со светофильтрами, осветители, камеры с живыми клетками и главный компьютер, необходимо выдержать при рабочей температуре, по меньшей мере, от 24 до 48 часов. Собирая камеру для получения изображений, убедитесь в том, что покровные стекла с адгезивными клетками надежно установлены на предназначенные для них места, а положение самой камеры на предметном столике микроскопа исключает ее перемещение в поперечном и продольном направлениях. При съемке изображений с высокими значениями разрешающей способности, источником дрейфа фокусировки может стать масляно-иммерсионный объектив, по мере распространения масла по покровному стеклу камеры и передней линзе объектива (для сухих объективов эта проблема отсутствует). Для всех иммерсионных систем следует использовать уже упоминавшиеся обогреватели объективов. Превосходным показателем стабильности системы, после термостабилизации микроскопа и подготовки всего остального оборудования к эксперименту, служит предварительная последовательность съемки неподвижно зафиксированного образца в течение заданных интервалов времени (за период 12–24 часа), с мониторингом фокусировки.
Сегодня производители микроскопов и дополнительного оборудования предлагают целый ряд программных и аппаратных средств для борьбы с дрейфом фокусировки. Одними из аппаратных средств являются системы автоматической фокусировки, основанные на принципе измерения расстояния между передней линзой объектива и образцом за счет обнаружения световых или звуковых колебаний, отраженных от нижней поверхности покровного стекла (ближайшей к объективу поверхности). Однако, при использовании иммерсионных объективов с высоким разрешением этот метод может оказаться неработоспособным из-за потери контрастности и отражательной способности при прохождении света (из системы измерения расстояния) через масло. В наиболее современных системах автоматической фокусировки в качестве источника излучения используется лазер низкой интенсивности ближнего инфракрасного диапазона или светоизлучающий диод (СИД). Излучение от такого источника направляется через объектив на верхнюю поверхность покровного стекла (сторона с клетками, погруженная в культуральную среду), отражается от этой поверхности, после чего собирается объективом и направляется на фотоприемник системы (цепи обратной связи), управляющей положением объектива относительно границы раздела «покровное стекло-культуральная среда».
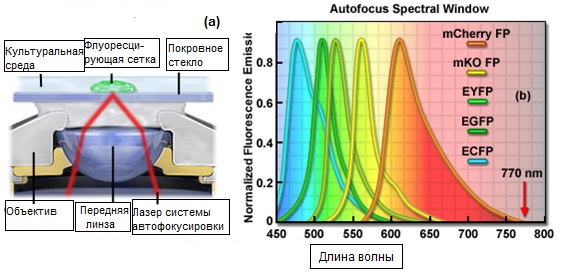
Рис. 5. Принципиальная схема типового механизма, использующегося для коррекции дрейфа фокусировки
Система обратной связи по положению образца позволяет за миллисекунды определять расстояние между покровным стеклом и объективом, и автоматически устранять дрейф фокусировки в режиме реального времени. Такие системы особенно удобны для ограничения дрейфа фокусировки, вызванного падением температуры при замене и перфузии культуральной среды, или при добавлении в культуру реагентов (например, лекарственных препаратов). Кроме того, постоянная коррекция фокусного расстояния облегчает выбор кандидатов на съемку из общего числа клеток, поскольку в процессе такого выбора необходимо перемещать предметный столик и определять местоположения точек съемки для получения коллекции изображений. Программное обеспечение, поставляемое с системами автоматической фокусировки, позволяет свободно выбирать фокальные плоскости посредством контроля смещения. Благодаря тому, что в системе автофокусировки используется длинноволновый лазерный или светодиодный источник (ближнего инфракрасного диапазона), его излучение не создает помех световым волнам, использующимся для наблюдения, и остается невидимым для приемника флуоресцентного излучения.
На рисунке 5 представлена принципиальная схема типового механизма, использующегося для коррекции дрейфа фокусировки в инвертированном микроскопе для наблюдения тканевых культур (рисунок 5(a)), а также сравнительное спектральное окно профилей (кривых) стандартных флуоресцентных белков и спектральной линии излучения лазерного источника системы автоматической фокусировки (рисунок 5(b)). Лазерный (или светоизлучающий) диод фокусируется на задней фокальной плоскости объектива и устанавливается параллельно его осевой линии, с определенным смещением. Цепь обратной связи исправляет небольшие, обусловленные дрейфом фокусировки, геометрические смещения луча, отраженного от границы раздела «верхняя сторона покровного стекла — культуральная среда». На рисунке 5(b) представлены спектральные профили излучения некоторых наиболее распространенных флуоресцентных белков, в диапазоне 450 — 700 нанометров, включая улучшенный циановый (ECFP), зеленый (EGFP) и желтый (EYFP) флуоресцентные белки, а также, сдвинутые в красную область, варианты кораллового рифа, мономеры Kusabira Orange (mKO) и mCherry. Из рисунка видно, что, использующееся в системе коррекции дрейфа фокусировки, излучение с длиной волны 770 нм не интерферирует с излучением флуоресцентных белков.
В лазерной сканирующей конфокальной микроскопии коррекция дрейфа фокусировки в ходе исследований, выполняющихся в течение заданных интервалов времени, часто осуществляется за счет получения нескольких аксиальных изображений в каждый из моментов времени, и последующего анализа каждой серии, с целью определения общей фокальной плоскости, которая соответствует предварительно заданной эталонной точке. В других методиках используются программно-реализованные алгоритмы, определяющие положение фокальной плоскости в промежутке между двумя моментами времени, при помощи функций контрастности, которые последовательно регистрируют изображения с пошаговым увеличением и уменьшением контрастности, и сравнивают результаты, пока не будет получен наибольший уровень контрастности (в точке задания фокуса для данного интервала). Программные методы коррекции дрейфа фокусировки базируются на относительно постоянном уровне контраста образца. Однако, довольно часто это не так, в частности, при получении изображений живых клеток, когда в поле зрения случайным образом вплывают соринки и возникают иные помехи, изменяющие видимое оптимальное положение фокальной плоскости.
Фототоксичность и фотоповреждение
Кроме токсичности, возникающей из-за чрезмерных концентраций синтетических флуорофоров и сверхсинтеза флуоресцентных белков, здоровье и продолжительность жизни оптимально окрашенных клеток в камерах для получения изображений страдают от ряда других вредных факторов. Главным из них является светоиндуцированное повреждение (фототоксичность), возникающее в результате повторяющегося воздействия на флуоресцентно окрашенные клетки светом лазеров и газоразрядных (дуговых) ламп высокой интенсивности. В возбужденном состоянии флуоресцентные молекулы склонны вступать в реакции с молекулярным кислородом, с образованием свободных радикалов, которые повреждают внутриклеточные компоненты и подвергают риску повреждения всю клетку. Кроме того, в некоторых отчетах высказывается предположение, что отдельные компоненты стандартных культуральных сред, включая витамин рибофлавин и аминокислоту триптофан, также могут вносить свой вклад во вредные светоиндуцированные воздействия на культивируемые клетки. В общем случае, флуоресцентные белки не токсичны для клеток, благодаря тому, что их флуорофоры погружены глубоко в защитную полипептидную оболочку. Однако, многие синтетические флуорофоры, например, MitoTracker и ядерные красители (Hoechst, цианиновые красители SYTO и DRAQ5), при освещении даже в течение коротких промежутков времени могут оказаться в высшей степени токсичными для клеток. Разрабатывая эксперименты, следует выбирать флуорофоры с максимальной допустимой длиной волны возбуждающего излучения, чтобы минимизировать повреждение клеток коротковолновым световым излучением.
На рисунке 6 представлены три примера фототоксичности, вызванной освещением клеток, окрашенных синтетическими флуорофорами или синтезирующих гибридные флуоресцентные белки. Показанные на рисунке 6(a) нормальные клетки почки кролика (RK-13) сначала были трансфецированы фузионным вектором EGFP и ядерной целевой последовательностью Т-антигена вируса SV40, с целью локализации зеленого флуоресцентного свечения внутри ядер. Затем, в течение 20 минут клетки обрабатывались красителем MitoTracker Red CMXRos, после чего последовательно получались их изображения с 30-секундными интервалами в течение 24-х часов. Через несколько часов в областях, содержащих митохондрии, которые окружали ядра, начинали образовываться вакуоли. На рисунке 6(b) представлена одиночная клетка глиобластомы человека (линия U-251), синтезирующая флуоресцентный белок mCherry, через несколько часов наблюдения слившийся с beta-актином человека. Отметим разрушение клеточной структуры, настолько значительное, что клетка, очевидно, входит в стадию некроза. Рисунок 6© иллюстрирует разъединение клеток эмбриона мыши-альбиноса (Swiss albino mouse) (линия 3T3) по истечении часа наблюдений после обработки ДНК-связывающим ядерным красителем Hoechst 33342. Обычно, поглощающие ультрафиолет ядерные красители (например, Hoechst), проявляют фототоксичность намного быстрее, чем зонды, возбуждаемые более длинноволновым излучением видимой части спектра.
Как уже упоминалось, имеются сообщения о том, что биологический буфер HEPES, при определенных условиях, также оказывает фототоксичное действие на клетки, (хотя, во многих случаях, этот эффект более логично объясняется несоответствующими уровнями бикарбоната). Исследователю необходимо иметь в виду, что, по своей природе, все клетки чувствительны к свету, а добавление в культуральную среду флуорофоров или ароматических компонентов только усугубляет эту чувствительность. Повреждения, причиняемые свободными радикалами, образующимися в результате возбуждения флуорофоров, можно только ограничить, но не предотвратить. Тем не менее, здоровые клетки обладают врожденными ферментативными механизмами преобразования свободных радикалов в менее вредные соединения, и способны переносить флуоресцентное возбуждение, при условии, что их ферментные системы не находятся в насыщенном состоянии. Снижение уровня кислорода в среде, при условии, что клетки способны переносить отвод кислорода, может послужить достижению двух целей: ограничить степень фотообесцвечивания и образования свободных радикалов.

Рис. 6. Эффекты клеточной фототоксичности, обусловленной синтетическими и генетическими флуорофорами
Независимо от способности клетки при помощи ферментов справляться с токсичностью, создаваемой флуорофорами и компонентами культуральной среды, в экспериментах по получению изображений следует свести воздействие света на клетки до минимально возможного уровня, а также ограничить воздействие других источников повреждения и минимизировать потенциальные искажения в ходе эксперимента. Дозу светового облучения, в расчете на один снимок, можно ограничить за счет рационального применения нейтральных светофильтров (для дуговых ламп), уменьшения выходной мощности источника освещения (для лазеров) и программирования затворов на пропускание света для возбуждения флуоресценции только на время получения изображения (съемки). Кроме того, необходимо тщательно подойти к выбору полос пропускания флуоресцентных фильтров, с тем, чтобы сократить диапазон и снизить интенсивность воздействия на клетки тех составляющих спектра, которые бесполезны для получения изображения. Успешно снижать уровни освещения при получении изображений живых клеток помогают объективы с высокой числовой апертурой, обладающие наилучшим светопропусканием при наименьшем количестве оптических элементов.
Чувствительность клеток млекопитающих к воздействию ультрафиолета, даже в отсутствие флуорофоров, подтверждена документально (явление, известное как фотоповреждение). Причем, многие клеточные линии, по меньшей мере, одинаково чувствительны к голубой составляющей диапазона, использующегося для возбуждения бирюзового (цианового) и зеленого флуоресцентных белков. Для минимизации фотоповреждения и фототоксичности в процессе подготовки эксперимента по получению изображений, настройку микроскопа необходимо выполнять при минимально возможных (с точки зрения наблюдения клеток) уровнях освещенности и, насколько возможно, быстро. С целью ослабления интенсивности освещения необходимо использовать нейтральные светофильтры (либо режимы очень низкой выходной мощности лазера), а визуализацию клеток лучше всего выполнять при помощи цифровой системы получения изображений. Для наблюдения клеток через окуляры микроскопа необходимо нескольких секунд, что, как минимум, в десять раз дольше, чем требуется для получения изображения удовлетворительного (для селекции клеток и фокусировки) качества. В качестве альтернативы, подходящие для получения изображений клетки можно определить, воспользовавшись методами светлого поля, фазового контраста или дифференциально-интерференционного контраста (ДИК). Во всех случаях, для повышения контрастности и минимизации воздействия на клетки голубой составляющей спектра, во время настройки следует использовать зеленый или красный интерференционный фильтр.
Широкое применение для получения изображений живых клеток получили светофильтры на длину волны 546 нанометров (зеленая составляющая). Их популярность связана с тем, что этот диапазон соответствует одной из главных спектральных линий излучения ртутных дуговых ламп. Однако, достижение должных уровней освещенности при получении изображений живых клеток редкая проблема, а современные объективы корректируются до такой степени, что не требуют использования зеленой составляющей спектра для получения изображений с высоким разрешением. Таким образом, освещение следует ограничивать диапазоном тех длин волн, которые успешнее всего переносятся клетками. Непосредственно перед делением (профаза), большинство линий клеток млекопитающих становятся очень чувствительными к ультрафиолетовому и инфракрасному излучению, и, в порядке убывания, менее чувствительными к красной, зеленой и голубой составляющим видимого спектра. Поэтому, идеальным вариантом, с точки зрения минимизации фотоповреждения и наблюдения живых клеток, является использование красных интерференционных светофильтров с полосой пропускания от 600 до 650 нанометров. Кроме того, при освещении светом длинноволновой части видимого спектра, в клетках и тканях млекопитающих ослабевает автофлуоресценция. Следует отметить, что оптическое разрешение зависит от длины волны. В этой связи красный свет дает наименьшие теоретические значения разрешения, поскольку обладает наибольшей, из рассматриваемых, длиной волны. Однако, в большинстве случаев использование красного света не является ограничивающим фактором, поскольку достигаемая при получении изображений живых клеток разрешающая способность часто ухудшается из-за внутриклеточной подвижности.
При выборе светофильтров для получения изображений живых клеток необходимо обратить пристальное внимание на полосы пропускания, с тем, чтобы исключить пропускание даже ничтожно малых уровней инфракрасного и ультрафиолетового излучений. Несмотря на то, что современные полосовые фильтры хорошо работают в центральных диапазонах спектра видимого света, они зачастую пропускают излучение с очень короткими и очень длинными длинами волн. Поэтому, для блокирования вредных ультрафиолетового и инфракрасного излучений рекомендуется устанавливать вблизи источника (источников) освещения специализированные стеклянные светофильтры. Ртутные и, в меньшей степени, ксеноновые лампы обладают высокими уровнями излучения в ультрафиолетовой области спектра, тогда как галогенные лампы накаливания с вольфрамовой нитью (пропускающие) излучают большое количество инфракрасных волн. И, наконец, с целью ограничения воздействия на клетки повреждающего излучения во время пауз в процессе получения изображений, необходимо установить для ламп обоих типов (дуговых и вольфрамово-галогенных) электронные затворы. Рациональная обтюрация источников освещения является одним из важнейших факторов успеха в экспериментах по получению изображений живых клеток.
Достижения последних лет в сфере фотоприемников способствуют еще большему снижению уровней освещенности при получении изображений живых клеток. Идет непрерывное внедрение катодных фотоумножителей повышенной чувствительности для конфокальной микроскопии и современных камер на структурах с зарядовой связью (ПЗС) для широкопольной микроскопии. Имеющиеся сегодня на рынке видеокамеры с электронно-оптическими преобразователями и электронными умножителями обладают высокой чувствительностью и дают возможность получать изображения живых клеток при чрезвычайно низких уровнях освещенности. Во многих из этих камер используются ПЗС, которые, обычно, охлаждаются и, для дополнительного повышения чувствительности, характеризуются высоким квантовым выходом в пределах видимого и ближнего инфракрасного диапазонов спектра. В отсутствие новейших камер, чувствительность можно повысить путем объединения сигнала от нескольких ячеек (процесс, известный как бининг), за счет пространственного разрешения. В конфокальной микроскопии поддержание низких коэффициентов трансфокации снижает уровень фототоксичности для клеток. Повышение конфокального коэффициента масштабирования ведет к тому, что меньший участок образца сканируется с использованием всего потока излучения лазера, подвергая клетки более интенсивному облучению.
Задача выбора точного уровня ослабления света и правильного времени экспонирования почти всегда решается эмпирически. Наилучший подход для исследования новой клеточной линии с неизвестными параметрами заключается в максимально возможном ослаблении освещения и использовании очень коротких выдержек (времен экспонирования), чтобы внутриклеточные структуры на полученном изображении были лишь едва заметны. Для начала целесообразно использовать нейтральный светофильтр с оптической плотностью 1,0 и выдержку длительностью 100 миллисекунд или менее. В случае использования лазерных сканирующих конфокальных микроскопов начните с выходной мощности лазера, равной, приблизительно, 1% и повышайте напряжение (и, при необходимости, коэффициент усиления) фотоумножителя. Используйте время воздействия излучения лазера на пиксели фотоприемной системы, приблизительно, на 50% короче тех значений, которые, обычно, обеспечивают достаточные уровни сигналов. В том случае, когда клетки выдерживают установленный уровень освещенности на протяжении длительных экспериментов с получением изображений в заданные промежутки времени, в последующих экспериментах интенсивность освещения и время экспонирования можно понемногу увеличивать, пока не будет достигнут рабочий компромисс между отношением сигнал/шум и жизнеспособностью клеток. Следует отметить, что, зависимость между полным оптическим экспонированием, которое способна выдержать клетка, и длительностью отдельных выдержек, зачастую, нелинейна. В общем случае, клетки выглядят наиболее здоровыми при освещении очень короткими импульсами света, поскольку длинные экспозиции (более половины секунды), зачастую оказываются летальными в течение длительных периодов времени.
Мониторинг жизнеспособности и вариабельности клеток
Следующий шаг после загрузки камеры для получения изображений свежими клетками, ее сборки и установки на предметном столике микроскопа, состоит в визуализации клеток, с целью определения их общего состояния и морфологии, а также выявления клеток, подходящих для получения изображений. В подавляющем большинстве экспериментов, особенно, при получении изображений клеток, которые недавно были кратковременно трансфецированы флуоресцентными белками, в популяции клеток наблюдается высокая степень морфологической вариабельности. В наличии нетрансфецированных, или проявляющих слабую локализацию окраски, клеток нет ничего необычного. Кроме того, некоторая часть трансфецированных клеток будет сверхпродуктивно синтезировать флуоресцентный белок, зачастую, до потенциально токсического уровня. У других клеток могут возникать проблемы общего характера со здоровьем (см. рисунок 7), проявляющиеся в виде отсоединения от субстрата, образования чрезмерного количества вакуолей, вспухших митохондрий и цитоплазматических пузырей. Одна и та же клеточная линия в различных культурах может демонстрировать различные картины образования нитей или пузырей, что может быть симптомом разных стресс-факторов. Часто ухудшение здоровья влияет на рост и подвижность клеток, приводя, в результате, к общему снижению активности. Однако, снижение активности клеток не является достоверным индикатором плохого здоровья, поскольку аномальные клетки могут демонстрировать заметное увеличение броуновского типа подвижности органелл. Не следует отбирать для получения изображений и сбора данных клетки, имеющие даже очень небольшие отклонения от нормы и здоровый вид. Более того, если более 50% популяции оцениваются как нездоровые, всю культуру следует ликвидировать и заменить другой, находящейся в лучшем физиологическом состоянии.
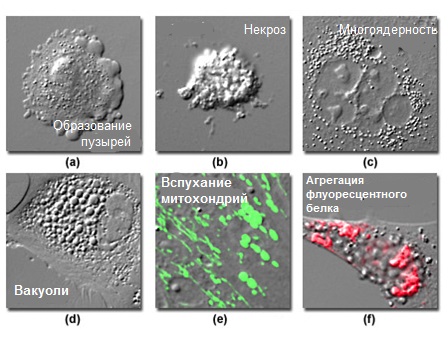
Рис. 7. Визуальные признаки морфологического изменения в нездоровых клетках
Во многих случаях эксперименты по получению изображений выполняются всего лишь с одной, либо, самое большее, с несколькими клетками. Исследователь должен иметь в виду, что морфология клеток в культуре может в значительной степени варьироваться относительно явно присутствующих фенотипов. Причина такой неоднородности может заключаться в том, что клетки находятся в разных фазах роста или, возможно, во внутренних различиях между отдельными членами популяции (последнее более очевидно в первичных культурах). По этой причине, зачастую необходимо зарегистрировать данные множества отдельных клеток, чтобы получить статистически значимую выборку характеристик и динамики поведения клеток. Как уже упоминалось, исследователь должен помнить, что для минимизации воздействия на результаты эксперимента, условия получения изображений живых клеток должны в минимальной степени беспокоить клетки. Одним из важнейших аспектов, позволяющих объективно оценить успешность эксперимента по получению изображений живых клеток, является выбор критерия для определения здоровья исследуемых клеток. Точные критерии зависят от конкретного эксперимента, однако, один из наиболее важных факторов, подлежащих принятию в расчет, состоит в том, удалось ли получить ожидаемый результат без повреждения клеток, подвергшихся процедуре получения изображений. В некоторых случаях изучаемое явления может соответствовать результатам, полученным со связанными клетками, однако, часто это невозможно.
Эксперименты по получению изображений необходимо контролировать, с тем, чтобы экспериментальные условия (культуральная среда, методика буферизации, атмосфера, конфигурация камеры) не оказывали значительного влияния на скорость роста, индекс частоты митозов или апоптические характеристики клеток. По возможности, следует по отдельности оценить возможное негативное влияние каждого из компонентов эксперимента. Например, клетки следует выращивать в культуральной среде, использующейся для экспериментов по получению изображений, в стандартном углекислотном инкубаторе, и оценивать их по жизнеспособности, индексу частоты митозов и общим морфологическим изменениям. Затем, в качестве окончательной проверки, можно на несколько часов поместить клетки в камеру для получения изображений (без освещения), после чего оценить по вышеупомянутым критериям. Такая методика позволяет изолировать различные факторы влияния на общее здоровье клеток и легко определить все подлежащие изменению процедуры.
Как уже упоминалось, в процессе получения изображений клетки получают большие дозы светового излучения. При этом, помеченные флуорофорами клетки потенциально подвержены формированию реакционноспособных молекулярных частиц, которые могут серьезно влиять на функцию клетки. Поэтому, допустимо (и целесообразно) предположить, что в ходе эксперимента по получению изображений будет иметь место некоторый уровень повреждения клеток. В связи с этим, необходимо принять меры по определению того, будет ли этот уровень достаточно высоким, чтобы породить отрицательные воздействия. Для этого лучше всего, по окончании эксперимента, оставить клетки в камере для получения изображений на предметном столике микроскопа, и периодически проверять их состояние, — возможно, клетки инициируют апоптоз, либо вступят в фазу митоза и осуществят его. В ходе оценки, в течение нескольких часов по окончании эксперимента можно получить изображения в определенных, широко разнесенных (от 10 до 30 минут) интервалах времени.
Критерии определения жизнеспособности клеток зависят от соответствующих метаболических путей в исследуемых клетках. Для некоторых трансформированных клеточных линий млекопитающих контрольные точки клеточного цикла отсутствуют, что делает определение развития митоза и апоптоза бесполезным. Следует тщательно [количественно] оценить каждый тип клеток, с тем, чтобы определить критерии, которые можно будет использовать для оценки их жизнеспособности после получения последовательностей изображений при помощи микроскопа. Один из наиболее простых способов оценки состояния клеток после получения изображений состоит в сравнении видимого здоровья и морфологии клеток, подвергшихся воздействию света во время исследования, с соседними клетками в той же камере, которые не подвергались освещению. Одинаковые характеристики этих двух популяций, при наблюдении по методу фазового или дифференциально-интерференционного контраста, являются надежным свидетельством сохранности хорошего общего состояния здоровья клеток. После этого следует получить флуоресцентные изображения, чтобы определить наличие или отсутствие изменений локализации флуорофоров в ходе эксперимента. И, наконец, обе популяции клеток следует периодически обследовать в течение нескольких часов (или дней) после эксперимента, с целью выявления возможных различий в поведении клеток, использовавшихся и не использовавшихся для получения изображений. Такое сравнение часто позволяет выявить наличие или отсутствие серьезных повреждений у исследуемых клеток.
Исследование митотического пути во время получения изображений живых клеток является превосходным механизмом отслеживания фотоповреждений. Зачастую, поврежденные чрезмерным освещением клетки, начавшие митотический цикл конденсацией хромосом (профаза), не вступают в прометафазу и не завершают процесс деления. Сканирование культуры при помощи микроскопа, работающего в режиме дифференциально-интерференционного контраста, позволяет выявить клетки, начавшие митоз. Благодаря этому можно выделить подходящие клетки для их более детального исследования в реальных условиях эксперимента по получению изображений. Деконденсация хромосом в течение периода наблюдений и отсутствие повторного вхождения клетки в фазу митоза в течение нескольких часов является достаточно веским свидетельством ее фотоповреждения. Следует отметить, что замена культуральной среды также инициирует во многих клетках декомпенсацию хромосом в профазе, поэтому, анализ следует выполнять через несколько часов после помещения клеток на предметный столик микроскопа. Клеточные линии очень сильно различаются по способности переносить воздействие света во время митоза. Устоявшиеся и первичные культуры клеток человека и животных могут быть чрезвычайно чувствительны к свету, тогда как клетки, полученные из эмбрионов (например, дрозофил и нематод), часто не имеют путей приостановки цикла деления в ответ на повреждение ДНК и более устойчивы к фотоповреждению.

Рис. 8. Три наиболее распространенных источника микробного загрязнения культур живых клеток
Кроме многочисленных проблем, связанных с фотоповреждением и фототоксичностью, а также строгих требований к сохранению живых клеток при визуализации их изображений, исследователь должен знать о возможности микробного загрязнения в ходе эксперимента, и принимать соответствующие меры. Наиболее распространены инфекции, вызываемые бактериями, грибками, микоплазмой, дрожжами, плесенью и, в редких случаях, простейшими. Если инфекция не стала обычным явлением, ее природа или возбудители не столь важны, как определение места ее происхождения. В общем случае, быстрорастущие организмы менее проблематичны, поскольку, как правило, легко обнаруживаются, благодаря чему от культуры можно избавиться на раннем этапе заражения. Более серьезные проблемы связаны с латентными инфекциями, которые, по причине физических размеров возбудителей или их размножения на уровне, недоступном для обнаружения, невозможно визуализировать во время обычного исследования культуры. Общей проблемой является чрезмерное использование антибиотиков в культуральной среде, что часто приводит к загрязнению низкого уровня, которое остается незамеченным в течение длительного времени, и может, в конечном счете, помешать нормальному функционированию клеток млекопитающего.
На рисунке 8 представлены микрофотографии, иллюстрирующие три наиболее распространенных источника микробного загрязнения культур живых клеток. При большом увеличении легко обнаруживается беспрепятственный рост бактерий (рисунок 8(a)), зачастую сопровождающийся быстрым падением pH культуральной среды. Когда количество организмов достигает насыщения, их присутствие (в виде помутнения культуральной среды) можно определить невооруженным глазом. Дрожжи (рисунок 8(b)) растут намного медленнее бактерий, но создают особый колониальный рисунок, выдающий их наличие. Заражение плесенью (рисунок 8©), обычно, охватывает культуру в течение 24 — 48 часов, и часто может проявляться в виде кустистой фиброзной интрузии. Но, все-таки, наиболее серьезная форма загрязнения не видна при использовании обычной микроскопии с повышением контрастности (фазовый контраст и ДИК). Микоплазма (не показана) может существенно изменить поведение и метаболизм клетки, и определяется в клеточных культурах только по, зачастую, едва различимым признакам. Анализы на микоплазму необходимо проводить регулярно, чтобы гарантировать отсутствие в культурах серьезных искажений при получении изображений живых клеток. Для обнаружения микоплазмы пригодны различные методы, включая флуоресцентное окрашивание (ядерным красителем Hoechst), полимеразную цепную реакцию и ауторадиографию.
Съемка в течение заданного временного интервала
Динамические изображения биологической активности были впервые представлены в 1909 году французским медиком Жаном Командо (Jean Comandon), который, на 5 лет раньше, чем Чарли Чаплин снял свой первый фильм, продемонстрировал самую первую, из известных истории, кинопленку (снятую в заданном временнóм интервале) с изображениями вызывающих сифилис спирохет. Метод Командо, который он назвал микрокинематографией, позволил снять фильмы о событиях в микромире при помощи громадной кинокамеры, привинченной болтами к хрупкому темнопольному микроскопу. Эти фильмы послужили для медиков учебным пособием в частности, в вопросе о том, как отличать вызывающие заболевание спирохеты от безвредных, а также продемонстрировали, как можно использовать наблюдения в течение заданных интервалов времени для получения важной биологической информации, без анализа изображения, обработки и даже без эмпирических количественных измерений. В течение последующих 75 лет многие исследователи приспосабливали к микроскопам все более совершенные кинокамеры, чтобы получать все более качественные снимки со все более высоким разрешением.
В конце 1970-х годов стали доступными видеокамеры с ЭЛТ (камеры с трубками), а уже в начале 1980-х годов исследователи стали подсоединять эти устройства к оптическим микроскопам и получать последовательности аналоговых изображений, снятых в заданные интервалы времени, а также видеоизображения в реальном масштабе времени. В конце концов, в начале 1990-х годов ЭЛТ камеры проложили путь ПЗС-матрицам, возвестившим о начале новой эры в микрофотографии и об окончательной кончине пленочных фильмов. При помощи доступных сегодня новейших цифровых видеокамер, набирающая популярность техника микрофотографии в заданные интервалы времени все шире применяется для получения изображений событий, происходящих в живых клетках, в течение периодов времени от нескольких секунд до нескольких недель (и даже месяцев). Эта техника состоит в многократном получении изображений клеточной культуры в определенные моменты времени, предоставляя информацию о бесчисленных динамических процессах, которые часто протекают в широких интервалах шкалы времени. Соединение метода получения изображений в заданные интервалы времени с окрашиванием клеток синтетическими флуорофорами и генетически кодированными флуоресцентными белками, позволяет изучать события на внутриклеточном и молекулярном уровнях.
С использованием широкопольного метода съемки в заданном интервале времени можно получать изображения в двух пространственных измерениях, а конфокальная микроскопия позволяет получать даже трехмерные изображения. Кроме того, современные конфокальные микроскопы комплектуются программным обеспечением для линейного (построчного) сканирования, позволяющим с высокой скоростью получать многократные изображения единичных строк растра. Получение двумерных изображений в заданные интервалы времени состоит в последовательной съемке единичных фокальных плоскостей (x-y — в широкопольной микроскопии; x-y, x-z и y-z — в конфокальной микроскопии), тогда, как при получении трехмерных изображений создаются «оптические стопки» из нескольких фокальных плоскостей в различных пространственных форматах для толстого образца. Методика соединения одиночной фокальной точки латеральной плоскости (x и y) с z-стопкой изображений в качестве функции времени, называется получением 4-D (четырехмерных) изображений в заданном интервале времени. Аналогично, добавление пятого измерения (длины волны) дает 5-D изображения, а добавление нескольких длин волн или нескольких латеральных областей к 4-D стопке, называется получением 6-D изображений в заданном интервале времени. Как уже упоминалось, интервалы времени, в течение которых формируется последовательность изображений с использованием описанных методов, могут длиться от нескольких миллисекунд до нескольких дней и даже месяцев.
Сегодня становится доступным все большее количество жизнеспособных синтетических флуоресцентных зондов с малым размером молекул. Такие зонды создают в высшей степени специфические распределения клеточных или внутриклеточных меток («паттернов мечения»). Кроме того, колоссальные усилия по созданию удобных флуоресцентных белков, диапазон излучения которых охватывает видимую и ближнюю инфракрасную области спектра, начинают давать обнадеживающие результаты. Сегодня зеленый флуоресцентный белок и, близкие спектральные варианты, синтезируются с другими (исследуемыми) белками, с целью выявления подробностей географии белка, движения, последовательности поколений и биохимии живых клеток. В этом отношении такие биологические зонды обеспечивают новый подход к пониманию функции белка и теперь, когда расшифрованы геномные последовательности многих организмов, являются очередным логическим шагом в исследовании клеточных процессов. Природная светимость и светоустойчивость многих флуоресцентных белков делает их особенно подходящими для многократного получения изображений, необходимых для съемки в заданном интервале времени. Совместное использование синтетических и генетически кодированных флуоресцентных зондов предоставляет, по-видимому, бесконечный набор возможностей для получения изображений молекулярных компонентов живых клеток.
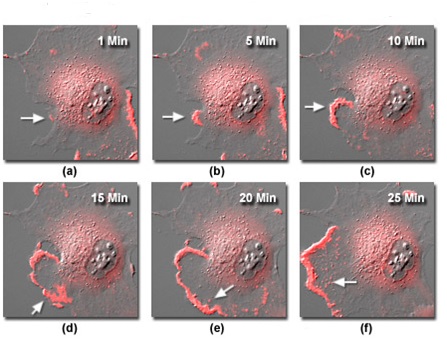
Рис. 9. Съемка живых клеток в заданный временной интервал в режиме флуоресценции и ДИК
На рисунке 9 представлено несколько изображений эпителиальных клеток почки кролика (RK-13), полученных в ходе 24-часовой съемки с использованием комбинации методов флуоресценции и дифференциально-интерференционного контраста. Клетки были трансфецированы химерным флуоресцентным белком mCherry, соединенным с человеческим beta-актином, с целью выявления распределения этих компонентов цитоскелета, а также ламеллиподий, в протопласте. Белая стрелка на рисунке 9(a) указывает на зарождение цитоплазматической волны (раффла) вблизи актинового пула в центральной части клетки. По мере продвижения по последовательности, небольшая волна начинает распространяться и волнообразно выпячиваться в направлении левой части изображения, концентрируя, по мере своего роста, в передней кромке ярко окрашенный, связанный с белком актин (показан стрелками на рисунках 9(b) — 9(d)). Когда ламеллиподия распространяется на большую область, за передней кромкой, в структурах, которыми могут быть подосомы, вовлеченные в процесс адгезии клеток к стеклянной подложке, образуются небольшие кластеры окрашенного актина (показаны стрелками на рисунках 9(e) и 9(f)).
Важную роль в реализации методики получения изображений в заданные интервалы времени играют некоторые вспомогательные устройства микроскопа, к примеру, электронные оптические затворы, диски со светофильтрами, моторизированные предметные столики, механизмы коррекции дрейфа фокусировки. Работа всех этих устройств может координироваться и управляться компьютером, на котором установлено программное обеспечение для получения изображений. Электронные затворы необходимы для блокировки освещения образца в промежутках между получением отдельных изображений флуоресцентно окрашенных клеток. Это позволяет минимизировать фотоповреждение, фототоксичность и фотообесцвечивание и, таким образом, резко повысить качество изображений и жизнеспособность клеток в течение длительных периодов времени при съемке в заданные интервалы времени. Для одновременного получения изображений с несколькими флуорофорами, а также при сочетании метода флуоресценции и ДИК, необходимо быстро менять флуоресцентные фильтры и/или поляризатор, что требует применения моторизированных дисков со светофильтрами. На практике возбуждающее излучение контролируется диском с двумя или более полосовыми фильтрами, а флуоресцентное излучение регистрируется через второй диск, в котором установлены полосовые или пороговые длинноволновые фильтры. Под объективом устанавливается широкополосное дихроичное зеркало, предназначенное для синхронизации функций блокировки и отражения возбуждающего излучения, с одновременным пропусканием эмиссионного излучения через один неподвижный оптический элемент. Современные диски позволяют переключаться с одного светофильтра на соседний за 30–50 миллисекунд. Рабочие характеристики электронных затворов лежат в этом же диапазоне, что, собственно, и является ограничивающим фактором в определении кратчайших возможных интервалов времени между двумя последовательными изображениями при съемке в заданном интервале времени.
В конфокальной микроскопии получение изображений в заданном интервале времени ограничивается скоростью сканирующих зеркал. Наибольшие скорости сканирования достигаются путем уменьшения размеров пикселей изображения и использования максимально возможной для прибора растровой скорости, однако, она, как правило, ограничена 8–10 кадрами в секунду. Для получения последовательностей изображений в короткие промежутки времени требуется однострочное сканирование, приборы с разверткой поля или микроскоп с вращающимся диском. Современные микроскопы с вращающимся диском и разверткой поля позволяют получать последовательности изображений на высоких скоростях, — от одного до нескольких сотен кадров в секунду. Эти скорости, обычно, ограничиваются только скоростью срабатывания цифровой камеры или фотоумножителя. Такие приборы предназначены для работы с бесчисленным множеством экспериментальных переменных.






.png)