Перфузионные камеры
Все многообразие, имеющихся на рынке (либо изготавливаемых собственными силами), культуральных камер делится на две основные функциональные категории. Первый и самый фундаментальный класс — открытые камеры — аналогичны рассмотренным выше чашкам Петри и специализированным предметным стеклам. В процессе использования такие камеры постепенно приходят в равновесие с окружающей атмосферой. Более сложные закрытые камеры герметичны, что обеспечивает защиту клеток от испарения культуральной среды и постоянство параметров окружающей среды: pH, концентрации двуокиси углерода и осмолярности. Как правило, камера открытого типа обеспечивает облегченный доступ к выращиваемым клеткам, что позволяет легко выполнять микроинъекции, фиксацию потенциала, добавлять препараты и метаболиты, менять культуральную среду и выполнять другие необходимые манипуляции с клетками. И, напротив, закрытые камеры обеспечивают превосходную изоляцию от внешней среды, но серьезно затрудняют доступ к клеткам. Большинство закрытых камер оборудуется портами для пополнения свежей культуральной средой и препаратами в ходе эксперимента, что позволяет не прерывать последовательность получения изображений. В таких системах перфузия регулируется перистальтическим насосом, либо опрыскивателем с приводом от двигателя, либо при помощи гравитационного манифольда. Вновь добавляемые в закрытую камеру растворы должны быть предварительно уравновешены по температуре и атмосферным параметрам с камерой для получения изображений. Более того, клетки многих линий чувствительны к сдвигающему усилию, поэтому, перфузию адгезивных клеток, соединенных с покровным стеклом, необходимо выполнять с очень малыми скоростями. Некоторые из описанных ниже, наиболее технологичных камер закрытого типа, оснащаются системами контроля сдвигающего усилия.
Обычно, выбор использования открытой или закрытой культуральной камеры определяется параметрами исследования, включая необходимые значения временнóго и пространственного разрешения, а также продолжительность эксперимента. Для получения изображений с высоким разрешением при светлопольных наблюдениях, с исползованием методов дифференциально-интерференционного, фазового или модуляционного хоффмановского контраста требуется, чтобы числовая апертура конденсора была равна числовой апертуре объектива, либо превышала ее. Таким образом, чтобы достичь максимального разрешения для объектива с увеличением в 60x и числовой апертурой 1,4, необходимо использовать согласованный конденсор с такой же числовой апертурой. Поскольку максимальное рабочее расстояние конденсора высокого разрешения, работающего в режиме освещения по Келеру, составляет всего лишь несколько миллиметров (в зависимости от рабочего расстояния конденсора), этот фактор ограничивает физические размеры камеры наблюдения. Небольшие закрытые камеры способны вмещать весьма ограниченные объемы культуральной среды (обычно, несколько сот микролитров), что может, в отсутствие перфузионной системы, создавать проблемы при исследовании долгоживущих культур.
Напротив, флуоресцентные исследования, для которых не требуются методы проходящего света с высоким разрешением, часто можно выполнять с использованием открытых камер, что облегчает задачу замены среды или выполнения иных манипуляций с культурой, (например, электрофизиологических измерений). Использование закрытых камер требует повышенного внимания к степени буферизации культуральной среды, поскольку стандартная система «бикарбонат натрия/двуокись углерода» не позволяет регулировать pH. В качестве альтернативных вариантов следует рассмотреть возможность использования среды, буферируемой без газа, либо добавления синтетических буферных добавок (например, HEPES). Различия в показателях преломления перфузата, покровных стекол («окон») и иммерсионной среды могут вносить значительные ошибки в результаты измерений глубины и приводить к ослаблению сигнала в любой перфузионной камере. Многие из этих искажений можно ослабить использованием водо-иммерсионных объективов, но, все же, в тех случаях, когда клетки соединены с покровным стеклом, качество изображения, выше.

Рис. 7. Серийные перфузионные камеры для визуализации живых клеток
На рисунке 7 представлены некоторые серийные перфузионные камеры, предназначенные для визуализации живых клеток с различным оптическим разрешением. Конструкция, показанная на рисунке 7(a), представляет собой автономную камеру искусственного климата (климатрон), вмещающую чашку Петри. Камера позволяет осуществлять перфузию, регулировку температуры, влажности и газового состава атмосферы. На рисунке 7(b) представлена перфузионная камера ромбовидной формы (рассматривается ниже) с переходником для установки на обогреваемый предметный столик, а на рисунке 7© показана аналогичная конструкция, но с круглой камерой. Обширная номенклатура адаптеров предметного столика, представленных на рисунках 7(b) и 7©, позволяет чрезвычайно точно настраивать параметры экспериментов с визуализацией живых клеток в физиологии и клеточной биологии. Представленная на рисунке 7(d) перфузионная камера (типа Ludin) допускает установку на направляющие и удобна для получения изображений нескольких образцов в едином эксперименте с применением перфузии. Хотя сама камера не обогревается, ее можно поместить на подогреваемый столик, либо использовать совместно с обогревателем объектива или с полностью закрытым климатроном. Представленная на рисунке 7(e) литая камера Петри-типа оборудована портами для подачи и выпуска перфузионных жидкостей, но не имеет средств регулировки (контроля) температуры. Камера, показанная на рисунке 7(f), содержит аналогичные порты и предназначена для установки в стандартные 6-камерные пластины с адгезивными клетками на пластмассовой поверхности для выращивания. Представленная на рисунке 7(g) перфузионная камера предназначена для установки на предметный столик микроскопа, имеющий круглую апертуру, и оборудована несколькими портами по периметру центральной лунки. Сегодня на рынке представлены сотни перфузионных камер для наблюдения живых клеток, поэтому, прежде чем выбрать какую-либо конструкцию, следует изучить ее пригодность для конкретного применения.
Среди важнейших аспектов конструкции перфузионной камеры следует особо выделить механизм механического крепления (при необходимости) и стабилизации образца, гидро и аэромеханические характеристики потока, время замены камеры, а также оптическое рабочее расстояние и показатели преломления иммерсионного масла, культуральных растворов и стеклянных пластин, через которые ведется наблюдение. Иммобилизация образцов для получения изображений живых клеток в закрытых или открытых камерах может обеспечиваться естественной адгезией к покровному стеклу, активатором склеивания, (например, поли-D-лизином или коллагеном), либо путем предварительного внедрения в тонкую агаровую накладку. Размеры стеклянной поверхности (необходимой для наблюдений) в перфузионной камере определяются требованиями, предъявляемыми к эксперименту. Для произвольных (выбранных случайным образом) клеточных популяций часто используются сравнительно небольшие покровные стекла. Однако, для очень больших клеток или сетей, а также в тех случаях, когда необходимо исследовать определенные события (например, митоз) могут понадобиться значительно бóльшие площади.
Независимо от площади поверхности покровного стекла, тонкие стеклянные пластинки (в идеале, толщиной 170 мкм), образующие лунку для образца, должны быть свободными от деформаций, оптически плоскими и параллельно ориентированными. Следует отметить, что большие области обзора сильнее подвержены утечкам и физическим повреждениям, но обеспечивают значительно больший доступ для объективов с большой числовой апертурой, тубусы которых, зачастую, имеют диаметр 3–5 сантиметров, (а с нагревателем такие объективы могут быть еще более громоздкими). Камера должна быть изготовлена из нетоксичных для живых клеток материалов и компонентов. Современные серийные культуральные камеры изготавливаются из стекла, нержавеющей стали, высокопрочных синтетических полимеров, политетрафторэтилена (тефлона) и силикона. Для окончательной сборки часто используются клеи. В некоторых из этих материалов могут присутствовать следы ядовитых тяжелых металлов или органических растворителей. Перед стерилизацией и применением эти следы необходимо удалить при помощи тщательной очистки.
Обычно, перфузионные камеры нужны для обеспечения выживания клеточной культуры в тех случаях, когда для выполнения исследования требуются очень длительные последовательности получения изображений, либо, когда необходимо периодически вводить в культуру метаболиты, [изотопные] индикаторы и/или лекарственные препараты, не нарушая, при этом, поле зрения. Кроме того, перфузионная камера позволяет периодически брать пробы культуральной среды для получения клеточных продуктов и проведения корреляционных исследований, когда образец в течение некоторого времени контролируется в живом состоянии, а затем внезапно связывается во время наблюдения, с целью реконструкции структурных или цитологических явлений, лежащих в основе исследуемого процесса. Главными преимуществами перфузии являются возможность поддерживать pH и ионную концентрацию среды в ходе длительных экспериментов, а также предоставление исследователю механизма введения различных реагентов (инфузируемых в камеру) без повреждения клеток. Например, перфузия позволяет вводить лекарственный препарат в культуральную среду в ходе последовательности получения изображений в заданных интервалах времени, не прерывая процесс съемки.
Одно из наиболее важных свойств перфузионной камеры заключается в том, что общая конструкция должна обеспечивать ламинарные характеристики потока, с тем, чтобы проходящие через камеру растворы можно было быстро и эффективно заменять при сравнительно слабом перемешивании. В некоторых случаях ламинарное течение может не иметь решающего значения, однако, в исследованиях с более жесткими условиями часто требуется строго контролируемая замена среды, в особенности, при добавлении дополнительных реагентов. Гидро и аэромеханические характеристики камеры тесно связаны с ее геометрией (см. рисунок 8). Ламинарное течение возникает в том случае, когда поперечные сечения камеры и ее впускного патрубка очень близки, или идентичны. Наиболее неблагоприятный характер поток приобретает в том случае, когда камера велика, в сравнении с входным патрубком. Рисунок 8 иллюстрирует характер потоков в некоторых популярных перфузионных камерах. Представленная на рисунке 8(a) камера обладает плохими обменными характеристиками, что обусловлено резким растеканием среды от отверстия впускного патрубка, в результате чего образуются неоднородные вторичные потоки. Постепенное расширение, показанное на рисунках 8(b) и 8©, формирует более равномерные потоки и быструю замену среды. Конусообразные участки возле впускного и выпускного патрубков камеры, показанной на рисунке 8(b) улучшают профиль потока, а ромбовидная форма камеры, представленной на рисунке 8©, обеспечивает более равномерный поток. Благодаря вытравленному каналу, который плавно направляет поток среды на образец, представленная на рисунке 8(d) камера с микроакведуком обеспечивает течение с превосходными по ламинарности характеристиками.
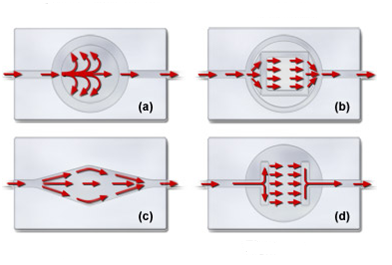
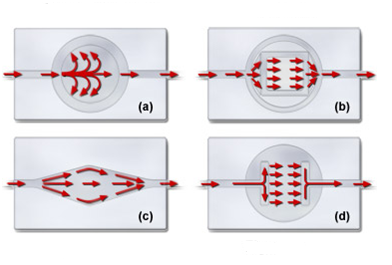
Рис. 8. Характер потоков в перфузионных камерах
Как уже упоминалось, часто возникает потребность в надежном и не создающем препятствий сбору электрических, химических и оптических данных методе перфузии клеток непосредственно в камере для получения изображений. Поток жидкости через перфузионную камеру возникает при замене среды, когда свежая жидкость поступает через впускной порт и заставляет использованную среду вытекать через выпускной порт. В большинстве своем, камеры для получения изображений живых клеток содержат очень малые объемы тканевой культуральной среды, поэтому, при выборе насосной системы необходимо учитывать чувствительность клеток к напряжениям сдвига во время перфузии, а также возможность возникновения вибраций покровного стекла в области апертуры (такие вибрации часто называют диафрагмальным эффектом). Во многих случаях процесс такого выбора, как и многие другие факторы получения изображений живых клеток, предполагает один, а то и несколько компромиссов. Идеальный перфузионный насос должен создавать строго контролируемый, чисто аналоговый поток среды на протяжении бесконечного периода времени. К сожалению, такие системы пока не созданы.
Стандартными методами доставки жидкостей посредством перфузии являются гравитационное течение, автоматическая или ручная инъекция при помощи шприца (см. рисунок 9(b)) и подача механическим насосом. Системы гравитационной подачи просты в установке и сравнительно дешевы, однако, при их использовании очень трудно контролировать потоки, типичные для потребностей микроскопии. Для создания системы гравитационной подачи в самой стандартной конфигурации требуется большой резервуар с культуральной средой, установленный выше микроскопа, соединенный стерильным трубопроводом с камерой для получения изображений. Скорость подачи регулируется игольчатым клапаном, установленным в выпускном патрубке на противоположном конце камеры; выпускной патрубок, в свою очередь, соединен с приемным резервуаром (отстойником). Альтернативно, скорость перфузии в гравитационной системе можно контролировать изменением вертикального расстояния между двумя резервуарами, либо при помощи запорного крана, регулирующего поток, поступающий из верхнего резервуара. Ламинарность потока, создаваемого гравитационной системой, часто ниже требуемой, но вполне приемлема в ситуациях, где главным требованием является возможность быстро заменить культуральную среду.
Для проведения экспериментов, основанных на добавлении прецизионных количеств лекарственных препаратов или других химикатов, а также для точного контроля напряжений сдвига на поверхности покровного стекла (в месте присоединения клеток), необходима более совершенная аппаратура. С улучшением геометрии камер скорость замены жидкостей, (а этот параметр может быть чрезвычайно важным в некоторых специальных экспериментах), увеличивалась. В современных перфузионных камерах полупериод замены жидкости, без нарушения латерального положения образца и аксиального положения фокальной плоскости, составляет 50 миллисекунд. В тех случаях, когда место слияния (соприкосновения) двух перфузионных растворов располагается близко к камере, при условии, что камера имеет малый внутренний объем и обеспечивает ламинарные профили течения, ступенчатое изменение концентрации может быть достигнуто менее чем за 100 миллисекунд, при сравнительно низкой скорости потока. Многие из имеющихся сегодня на рынке перфузионных камер удовлетворяют этим критериям.
Периодическое добавление факторов роста, ингибиторов, лекарственных препаратов и других метаболитов в процессе перфузии можно легко осуществлять при помощи ручных шприцев. Наиболее надежными устройствами для доставки перфузата являются механические насосы, устанавливаемые в конструкциях с перистальтическими (рисунки 9(a) и 9(b)) или механизированными (рисунок 9(e)) шприцами. В длительных экспериментах применение шприцевого насоса ограничивается объемом, а также колебаниями доставки жидкости в пределах микролитровой шкалы (из-за временного «заедания» поршня шприца). Насосы с приводом от шаговых двигателей могут работать на очень малых скоростях, однако, мгновенные перемещения ротора создают гидродинамические импульсы, которые могут приводить к изгибанию покровного стекла или смыванию (смещению) клеток. Усовершенствованные перфузионные камеры оснащаются регулируемыми двигателями постоянного тока, соединенными с понижающим редуктором, который приводит в движение вал ролика, оборудованного регулятором скорости. В результате создается поток с профилем, свободным от резких пульсаций, обычных для более дешевых перистальтических насосов. Выбирая перфузионную систему доставки, необходимо учитывать требуемую интенсивность потока (скорость подачи), его равномерность в течение различных промежутков времени, а также суммарный объем доставки и качество потока.
Кроме того, для обеспечения требуемых характеристик потока среды в перфузионной камере, необходимо также уделять внимание контролю температуры и газового состава подаваемых растворов. В случае использования буферной системы из двуокиси углерода и бикарбоната, все перфузионные растворы должны оставаться уравновешенными по соответствующему парциальному давлению двуокиси углерода (в зависимости от концентрации бикарбоната) и иметь ту же температуру, что и культуральная камера. Таким образом, перед подачей в перфузионную камеру перфузионные растворы должны подвергаться газированию и уравниванию температуры. Следует помнить, что по мере повышения температуры растворимость двуокиси углерода снижается. Поэтому растворы необходимо газировать при температуре, заданной для камеры, или же вводить для газовой смеси поправку на разность температур. Для поддержания необходимой температуры и газового состава растворов рынок предлагает широкий спектр серийно выпускаемого оборудования. Или же, соответствующие устройства можно без особого труда изготовить в лабораторных условиях, из самых обычных компонентов. Простую камеру влажности можно изготовить из сосуда со средой, трубопроводов и сепаратора (рисунок 9(с)), а температуру можно контролировать при помощи циркулярной водяной бани или настольного инкубатора. Более многофункциональные устройства (рисунок 9(d)) предназначены для одновременного регулирования pH и влажности. Поскольку статические растворы среды имеют склонность остывать и терять двуокись углерода (и, как следствие, в них повышается уровень pH), необходимо все растворы подавать в перфузионную камеру по газонепроницаемым трубопроводам, проходящим через подогреваемую водяную баню или инкубатор.
Выбор трубных соединителей для экспериментов с перфузией живых клеток следует ограничить изделиями (предпочтительно, имеющими сертификат USP класса VI) с максимальной степенью биосовместимости, чтобы во время сеансов получения изображений исключить токсичность, обусловленную элементами трубопроводов. В настоящее время этому требованию удовлетворяют три серийно выпускаемые марки трубопроводов: PharMed (имеется у большинства продавцов), Tygon 2275 и C-Flex. Хотя трубопроводы марки PharMed хорошо подходят для клеточных культур, их главным недостатком является низкая прозрачность, снижающая возможность видеть поступающий по трубопроводу перфузат. Это затрудняет обнаружение пузырьков, которые могут образовываться при движении перфузата по трубопроводу. И напротив, трубопроводы C-Flex и Tygon практически прозрачны и не склонны к выделению пластификаторов в перфузат. Два последних продукта идеально подходят для большинства экспериментов с применением перфузии.


Рис. 9. Принадлежности для реализации перфузии в культуральных камерах для визуализации живых клеток
Потенциальная проблема при использовании перфузионных камер заключается в резком выходе образца из фокуса. Это явление связано с ограниченным изгибанием покровного стекла при инициации или прекращении процесса принудительной подачи жидкости в камеру (диафрагмальный эффект). Этот недостаток проявляется в камерах с плохим контролем перфузии. Изгибание покровного стекла может не создавать серьезные проблемы в тех случаях, когда последовательность получения изображений можно чередовать с сеансами перфузии, однако, способно значительно влиять на результаты исследований, требующих сравнительно высокого временнóго разрешения (2 секунды и менее). Степень изгибания покровного стекла можно минимизировать уменьшением диаметра впускного порта (и трубных соединителей), по сравнению с диаметром выпускного порта, с тем, чтобы вдоль потока не аккумулировалось гидростатическое давление. И, наконец, диафрагменный эффект можно ослабить, или полностью ликвидировать, заменив систему гравитационной подачи системой с перистальтическим насосом.
Основная проблема при использовании перфузионных камер заключается в образовании воздушных пузырьков (вследствие утечек, сил поверхностного натяжения и дегазации). Эти пузырьки могут создавать помехи ламинарному течению культуральной среды, а также ухудшать контрастность и резкость получаемых изображений. Правильно сконструированная перфузионная камера представляет собой закрытую систему, в которой скрытый воздух или потенциальные утечки в камере или в соединиениях устраняются после установки образца под микроскоп, но до начала эксперимента. Простейший метод удаления воздушных пузырьков из гравитационной системы заключается в следующем: необходимо заполнить резервуары и камеру, перекрыть поток жидкости через систему, а затем медленно удалить воздух из запорного крана, контролируя все компоненты. Удалить воздух из камеры, оборудованной насосной системой, как правило, значительно труднее. Поэтому, необходимо обращать пристальное внимание даже на мельчайшие воздушные пузырьки, которые могут скрываться в пространстве камеры между покровным стеклом и перфузионными портами. В любом случае, чтобы минимизировать изгибание покровного стекла в моменты включения и выключения перфузии, перед первой операцией перфузии необходимо полностью закрыть и заполнить всю систему жидкостью. Выпускной патрубок (трубопровод) должен быть погружен в приемный резервуар, чтобы избежать проникновения через него пузырьков в камеру.
В большинстве экспериментов требуется, чтобы впускной и выпускной патрубки перфузионной камеры не препятствовали смене объективов микроскопа. В большинстве камер слоеной конструкции эти патрубки располагаются на одной или на противоположных сторонах камеры. Такие камеры зачастую используются как с прямыми, так и с инвертированными микроскопами. Однако, камеры с портами (патрубками) в верхней части корпуса могут препятствовать перемещению револьверной головки с объективами прямого микроскопа. Многие современные серийно выпускаемые камеры (см. рисунки 1 и 7) совершенно не мешают повороту револьверного держателя объективов микроскопа в пределах полного оборота. Тем не менее, прежде чем выбрать ту или иную камеру, это обстоятельство необходимо проверить в первую очередь. Кроме того, будучи установленными на инвертированный микроскоп в больших металлических адаптерах, пластмассовые перфузионные камеры и камеры визуализации живых клеток могут не обеспечивать необходимый зазор для поворота револьвера объективов, без необходимости убирать (опуская вниз) объективы от камеры.
Хотя, в подавляющем большинстве исследований с получением изображений живых клеток культура должна содержаться при температурах, превышающих температуру окружающей среды, некоторые эксперименты связаны с наблюдением организмов, которые необходимо выращивать при очень низких температурах, тогда, как в других исследованиях изучается резкое охлаждение образца. В идеальном случае, для проведения длительных экспериментов микроскоп должен находиться в прохладном помещении, чтобы избежать конденсации воды на холодных поверхностях при комнатной температуре. На случай отсутствия холодного помещения на рынке имеются перфузионные камеры, предназначенные для низкотемпературных экспериментов. Работа этих устройств, зачастую, основана на снижении температуры путем пропускания охлажденных спиртовых растворов через спиральные трубопроводы (змеевики). Чтобы избежать нагревания образца теплом от конденсора и объектива, для этих элементов микроскопа могут потребоваться специальные устройства охлаждения, а для предотвращения образования инея, наружные стеклянные поверхности можно покрыть средством Photo-Flo (Kodak), или аналогичным составом. Независимо от требований эксперимента к температуре, следует отметить, что, зачастую, поддержание того или иного точного значения температуры не столь важно, как последовательное достижение и устойчивое поддержание постоянства температуры.
Усовершенствованные закрытые и открытые камеры для визуализации живых клеток
В общем случае, наиболее распространенными приборами для наблюдения живых клеток являются инвертированные микроскопы (лабораторные микроскопы). С рядом важных отступлений, прямые микроскопы также можно адаптировать для этой цели. В этой связи требуется тщательная проработка эксперимента (вне зависимости от конфигурации штатива микроскопа); необходимо определить ряд параметров, связанных с глубиной поля, а именно: требуемый коэффициент увеличения, ограничения по рабочему расстоянию и оптимальную числовую апертуру. В большинстве случаев, для исследования клеточных культур млекопитающих с контролем температуры лучше использовать иммерсионные объективы (водные или масляные). При исследованиях в проходящем свете с использованием конденсоров с высокой числовой апертурой, выбранная камера должна соответствовать требованиям к определенному рабочему расстоянию, физическим размерам передней линзы конденсора и расстоянию от передней линзы конденсора с маслом, до поверхности стеклянного окна камеры. Кроме того, для обеспечения надлежащего зазора, геометрия предметного столика микроскопа также должна согласовываться с размерами камеры. В целом, благодаря большому рабочему расстоянию конденсоров и возможности использовать объективы с высокой числовой апертурой непосредственно на оптической поверхности с клетками, для наблюдения живых клеток лучше подходят инвертированные микроскопы.
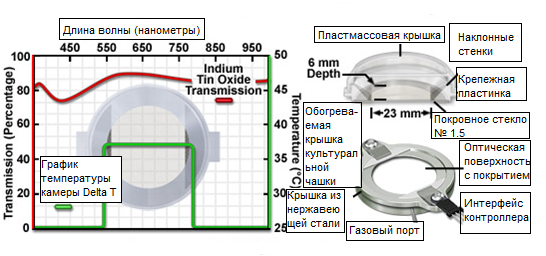
Рис. 10. Конфигурация камеры для визуализации живых клеток Bioptechs Delta T4
При использовании усовершенствованных открытых культуральных камер необходимо учитывать множество различных параметров. В частности, следует обратить внимание на объем, размер апертуры, конструкционные материалы, толщину покровного стекла, геометрию и биологическую совместимость камеры. Среди прочих факторов, способных повлиять на успех эксперимента, следует выделить испарение (и конденсацию), окружающее освещение, угол обзора и лабораторные условия. Все вышеперечисленное касается также и самых сложных закрытых камер, однако, в этом случае важны и некоторые другие характеристики. К таким характеристикам следует отнести постоянство или изменяемость объема камеры, зазор между оптическими поверхностями, скорость замены жидкости, ламинарность, напряжение сдвига, градиенты и геометрию канала перфузионного потока. Кроме того, для камер обоих типов важными требованиями являются регулирование (и равномерность) температуры, а также тепловое воздействие масляно- или водо-иммерсионных объективов.
Камеры закрытого типа требуются в тех случаях, когда культура должна быть полностью изолирована от внешней среды, или же при использовании современных методов улучшения контраста в оптической микроскопии в проходящем свете (например, ДИК с высоким разрешением). В таких случаях клетки помещаются в перфузируемый оптический резонатор с регулируемой температурой, либо выращиваются непосредственно на покровном стекле, представляющем собой нижнее оптическое окно камеры. Сегодня на рынке представлен широкий спектр традиционных и усовершенствованных закрытых камер для визуализации живых клеток. Подавляющее большинство конструкций обладают похожими характеристиками и имеют две оптические поверхности, разделенные перфузионным кольцом с уплотнительными прокладками. Эта многослойная конструкция зажимается в металлическом или композитном корпусе. К недостаткам многих закрытых камер можно отнести чрезмерно большой зазор между оптическими поверхностями, нерегулируемый объем оптического резонатора, низкие скорости замены жидкости, турбулентность перфузии, сложность загрузки и наличие утечек. Ниже описаны некоторые из самых совершенных открытых и закрытых камер для получения изображений, конструкции которых акцентированы на решение самых распространенных проблем и позволяют получать изображения превосходного качества.
Открытая камера Bioptechs Delta T
Культуральная камера Bioptechs Delta T обладает рядом новаторских конструкционных особенностей, которые могут способствовать получению поразительных результатов в широком диапазоне как статических, так и связанных с перфузией, экспериментов по получению изображений живых клеток. Сконструированная по принципу традиционных открытых камер на базе чашек Петри, культуральная камера Delta T состоит из 35-миллиметровой чашки, приклеенной к покровному стеклу толщиной 170 микрометров, полностью перекрывающему дно, и использует механизм теплопередачи лицевой поверхностью для контроля температуры (см. рисунок 10). Метод регулирования температуры базируется на использовании тонкопленочного покрытия из оксида индия и олова (ITO) — прозрачного электропроводящего слоя, нанесенного на нижнюю поверхность покровного стекла. Когда чашка надлежащим образом установлена в специальный адаптер предметного столика, токопроводящие контакты, нанесенные на противоположные ребра покровного стекла, соединяются с группой электродов. Температура регулируется с использованием термисторной цепи обратной связи (во внешнем регуляторе), которая создает электрический ток в покрытии нижней стороны покровной пластины, нагревая, таким образом, всю чашку до требуемой температуры. Скорость термического реагирования такой системы равна, приблизительно, 0,1 градуса Цельсия в секунду.
Высокое быстродействие системы Delta T позволяет включать и выключать электрический ток в течение секунд, позволяя компенсировать изменения температуры, возникающие в чашке из-за поверхностного испарения, энтропии или перфузии. Кроме высокоскоростной цепи регулирования, система оборудована быстродействующей схемой аварийной защиты, предназначенной для защиты клеток в случае отказа регулятора. Система обеспечивает получение изображений с высоким разрешением через свободные от напряжений стеклянные поверхности и поставляется с покровными стеклами различной толщины, включая покровное стекло номер 1.5, предназначенное для использования с объективами с высокой числовой диафрагмой. Окружающая среда в чашке совместима с популярными, улучшающими контрастность, режимами светлопольной, темнопольной, поляризационной микроскопии фазового контраста, ДИК, HMC, флуоресцентной, многофотонной и конфокальной микроскопии.
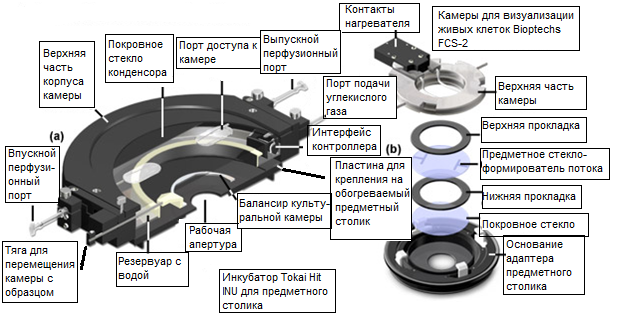
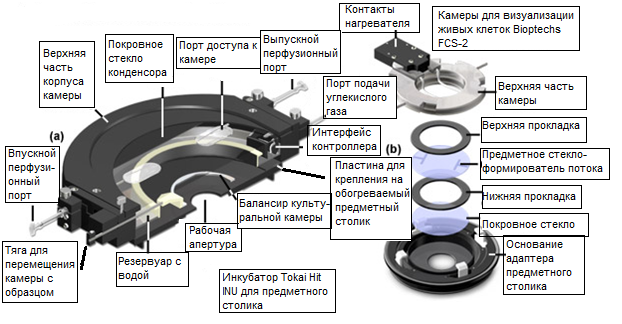
Рис. 11. Усовершенствованные камеры для визуализации живых клеток
Представленный в 1993 году, метод теплопередачи лицевой поверхностью с использованием тонкопленочного покрытия на покровном стекле является основой для широкого спектра модификаций и вариаций базового принципа. Например, система Delta T и аналогичные системы весьма удобны для контроля температуры при исследованиях срезов тканей, которые могут находиться во взвешенном состоянии в оптической базовой плоскости на соответствующем фокусном расстоянии от объектива. Кроме того, система позволяет легко устанавливать адаптеры для обеспечения перфузии малыми дозами в течение длительных промежутков времени. К чашкам Delta T выпускаются точно притертые крышки для использования в экспериментах с высокой числовой апертурой, с целью установления оптически правильной поверхности над образцом, при полном заполнении культуральной средой или буферным раствором для получения изображений. Это позволяет исключить границу раздела между воздухом и поверхностью среды, предотвращая изменения контрастности изображения, обусловленные малейшими флуктуациями в объеме среды над объективом. Кроме того, оптически прозрачную крышку в виде электрически обогреваемого покровного стекла можно использовать в экспериментах с низким увеличением в проходящем свете, либо с высоким увеличением в экспериментах с флуоресценцией. Регулирование температуры покровного стекла-крышки предотвращает образование конденсата на нижней поверхности. Более того, наличие газового порта позволяет использовать обогреваемую крышку для поддержания концентрации двуокиси углерода в культуральной атмосфере в течение длительных периодов времени. Охлаждение образцов в системе Delta T можно осуществлять погружением в чашку спирального трубопровода с циркулирующей в нем охлаждающей жидкостью.






.png)