Благодаря растущему числу исследований, использующих методы визуализации живых клеток, и стремительным успехам в области технологии флуоресцентных белков и синтетических флуорофоров, складывается принципиальное понимание природы функционирования клеток и тканей. По существу, визуализация живых клеток стала не только необходимым инструментом в большинстве биологических лабораторий, занимающихся изучением клеток, но и стандартной методикой, применяющейся в различных областях нейробиологии, биологии развития, фармакологии и других биомедицинских дисциплинах.
Моторизированные микроскопы: системы управления затворами, дисками со светофильтрами, фокусировкой, предметным столиком и освещением.
Автоматические компоненты и вспомогательные устройства для микроскопов позволяют автоматизировать процесс получения изображений живых клеток, и особенно удобны в экспериментах с периодической съемкой в заданные временные интервалы, которые могут длиться от миллисекунд до десятков и сотен минут. Вспомогательные устройства, такие, как электромеханические затворы, микропроцессорные устройства автоматической смены фильтров (диски со светофильтрами), моторизированные предметные столики и аксиальные механизмы управления фокусировкой могут быть адаптированы к микроскопам исследовательского уровня и интерактивно управляться с дополнительной рабочей станции при помощи различных коммерческих программных пакетов для регистрации и визуализации изображений. Однако, следует отметить, что сборка полностью автоматизированной и оптимизированной многомерной оптической системы получения изображений — это чрезвычайно сложная задача.

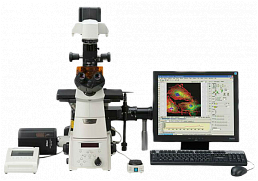
Рис. 1. Конфигурация системы для визуализации живых клеток
Сегодня рынок предлагает различные системы (очень дорогие), но, зачастую, стоит вложить в них средства для создания многопользовательской центральной станции. В принципе, затраты можно уменьшить, минимум, на 50%, собрав систему «с нуля». Однако, такие попытки — прерогатива лабораторий, обладающих достаточными знаниями и опытом в оптической микроскопии. Основная проблема создания автоматического микроскопа состоит в объединении разнородных аппаратных и программных компонентов в хорошо координированную, действующую систему. Новейшие микроскопы от ведущих производителей все в большей степени оснащаются современными высокоскоростными затворами, системами коаксиальной фокусировки, устройствами автоматической смены фильтров, средствами управления интенсивностью освещения и его источником, а также другими моторизированными компонентами, интегрированными в единую систему, превосходно работающую под управлением фирменного программного обеспечения.
Обобщенная конфигурация системы для визуализации живых клеток, созданная на основе инвертированного микроскопа для наблюдения тканевых культур, представлена на рисунке 1. Все показанные вспомогательные компоненты необходимы для сохранения культуры в процессе получения изображений в режимах светлого поля, фазового контраста, дифференциально-интерференционного контраста и флуоресценции. Камера с образцом помещается на столике и, как правило, неподвижно закрепляется (за исключением простых предметных стекол) над круглым или прямоугольным отверстием, непосредственно над объективами. Для поддержания в культуральной камере необходимой окружающей среды культуральная камера вместе с конденсором, предметным столиком и револьвером объективов микроскопа, заключается в плексигласовый кожух. Датчик и подающий резервуар двуокиси углерода подключены к тому же устройству, которое контролирует температуру в кожухе; обогреватели предметного столика и объективов управляются дополнительными устройствами. Диски с фильтрами возбуждающего и испускаемого излучения, а также ПЗС-камера, управляются отдельным устройством, соединенным с главным компьютером (не показан). Все оборудование устанавливается на изолированную от источников вибрации лабораторную платформу.
Оптические затворы
Электронные затворы используются для блокировки освещения образца в промежутках между получением отдельных снимков (экспозициями), и особенно важны в качестве средств минимизации фотообесцвечивания и фототоксичности при получении изображений чувствительных флуоресцентных образцов. Эти устройства совершенно необходимы для сохранения жизнеспособности клеток при получении их изображений в течение длительных периодов времени. Кроме того, затворы можно использовать для выбора соответствующего источника освещения и пути светового потока, например, для быстрой смены режимов проходящего и флуоресцентного освещения при получении двух изображений в одной временнóй точке заданной последовательности изображений. Современные высокоскоростные затворы с микропроцессорным управлением способны работать в нескольких режимах, что дает пользователю возможность управлять скоростью работы механизма, реализующего функцию затвора. Быстрый режим обеспечивает самую быструю, из возможных, последовательность операций открывания и закрывания затвора.
Несколько более медленный мягкий режим постепенно открывает и закрывает затвор, обеспечивая пониженный уровень вибрации и более тихое срабатывание. Управление интенсивностью освещения без воздействия на длину его волны реализуется в режиме затвора нейтральной плотности. Этот режим дает возможность управлять действующим размером апертуры в открытом состоянии затвора, что позволяет последнему работать в качестве нейтрального светофильтра. Многие контроллеры затворов могут работать в нескольких режимах, и оборудованы интерфейсом с рабочей станцией, что позволяет синхронизировать работу двух и более затворов. Срок службы наиболее надежных затворов исчисляется миллионами рабочих циклов.
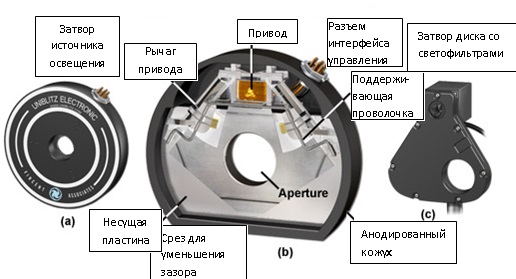
Рис. 2. Затворы для визуализации живых клеток
На рисунке 2 представлено несколько конструкций затворов, широко распространенных в микроскопии живых клеток. На рисунке 2(a) представлена базовая система затвора в разрезе (рисунок 2(b)), показывающая внутреннее устройство рабочего механизма. При помощи привода с коромыслами, оснащенными демпфирующей системой, состоящей из амортизаторов и фасонной проволочной пружины, лепестки затвора поворачиваются по принципу гильотины и закрывают апертуру. Через электронный интерфейс арматура затвора соединяется с внешним устройством управления, которое может работать как автономно, так и под управлением главного компьютера. Участок усеченной формы в основании затвора позволяет устанавливать затвор максимально близко к корпусу микроскопа, во избежание взаимных помех в отношении других деталей. Представленный на рисунке 2© затвор для светофильтров может работать как автономно, так и в составе автоматизированного диска со светофильтрами (описывается ниже), и позволяет одновременно, с высокой точностью управлять выдержкой и длиной волны.
Апертуры затворов для микроскопов имеют диаметр от 25 до 35 миллиметров. Модели с малыми апертурами работают быстрее, но, зачастую, ограничивают поле зрения и, в некоторых микроскопах, могут создавать эффект виньетирования. Затворы с большими апертурами обладают меньшим быстродействием, но уменьшают, либо вовсе устраняют краевые (пограничные) эффекты освещения. Кожух затвора, обычно, вытачивается или отливается из алюминия и анодируется, после чего окрашивается в черный цвет и служит радиатором для обмотки электромагнита привода. Для удобства монтажа многие затворы могут устанавливаться без кожуха, однако, в этом случае лепестки и другие внутренние детали подвергаются воздействию пыли и других загрязняющих веществ. Для минимизации нагревания горячими дуговыми лампами, лепестки затворов для микроскопов должны иметь отражающее покрытие на входной (обращенной к источнику освещения) стороне. Типичное высококачественное отражающее покрытие изготавливается из сплава алюминия и фторида магния, который наносится на бериллиево-медную подложку. Лепестки более дешевых затворов изготавливаются из полированной нержавеющей стали. Последние, в сравнении с лепестками из сплава, обладают меньшей отражающей способностью и хуже рассеивают тепло, зато намного дешевле и более долговечны.
Выбор длины волны
Одним из важнейших компонентов автоматического получения цветных флуоресцентных изображений является устройство, позволяющее быстро переключаться на работу со световыми волнами различной длины. Такое переключение может осуществляться за счет использования нескольких фильтров, светоделительных устройств, направляющих свет по нескольким оптическим путям, монохраматоров или акустооптических настраиваемых фильтров (AOTF). В стандартной конфигурации традиционный набор флуоресцентных фильтров собирается в оптический блок, который содержит фильтр возбуждения и пороговый (или эмиссионный) фильтры, а также дихроичное зеркало, направляющее возбуждающее световое излучение на образец и пропускающее свет к фотоприемнику. В усовершенствованной системе визуализации живых клеток дихроичное зеркало сохраняется, но часто заменяется полихроматическим вариантом с несколькими полосами пропускания. Фильтры для возбуждающего и испускаемого излучения удаляются из оптического блока и устанавливаются в одно (или несколько) описанных далее внешних устройств. В настоящее время применяется несколько механизмов автоматической смены флуоресцентных фильтров. В наиболее распространенном из них используются вращающиеся диски со светофильтрами — надежные, сравнительно недорогие и поддерживаемые (фактически, внедряемые) большим числом программ получения изображений (от производителей, как основного, так и вспомогательного оборудования). Основной недостаток таких дисков состоит в ограничении скорости переключения. Среди основных преимуществ дисков для светофильтров следует отметить их высокое светопропускание и универсальность, позволяющую использовать их с широким спектром имеющихся в продаже светофильтров.
Такие диски предназначены для крепления от 4-х до 10-и круглых плоских оптических интерференционных светофильтров, а также нейтральных, тепловых и ультрафиолетовых светофильтров диаметром от 25 до 50 миллиметров (см. рисунки 3 и 4). Диск монтируется в алюминиевом кожухе, обеспечивающем легкий доступ к фильтрам в случае их замены, и приводится в движение прецизионным шаговым двигателем, который, в свою очередь, управляется внешним устройством (см. рисунок 4(a)). В кожухе имеется оптический порт (в который последовательно можно установить любой фильтр) для соединения (через специальные адаптеры) с микроскопом и источником освещения. Кроме того, многодисковые кожухи могут оснащаться затворами с болтовым креплением. Высококачественные диски для светофильтров оснащаются монтажными проушинами, что позволяет надежно крепить их на оптической скамье или на виброизолирующем столе. Некоторые диски оборудуются сменными или вставными держателями для дополнительных (например, нейтральных) светофильтров, которые устанавливаются последовательно с интерференционными фильтрами, находящимися непосредственно в диске. Модуль управления диском со светофильтрами может, в свою очередь, управляться встроенным микропроцессором и работать, как автономное устройство, либо может подсоединяться к рабочей станции, управляющей несколькими дисками со светофильтрами, затворами, цифровыми камерами и другими периферийными устройствами.
Для поворота и установки очередного светофильтра в оптический порт стандартному недорогому диску требуется до 100 миллисекунд, тогда как более дорогие и быстродействующие диски выполняют эту операцию, приблизительно, за 25 миллисекунд. Хотя, на первый взгляд такие скорости и могут показаться достаточно высокими, при скорости переключения 100 миллисекунд для регистрации аксиальной серии из 20-и оптических срезов на двух длинах волн, на переключение требуется, в сумме, минимум, 4 секунды, что сильно ограничивает скорость получения изображений быстрых клеточных процессов. Кроме того, диски со светофильтрами способны создавать механические вибрации, которые через штатив микроскопа могут достигать фотоприемника и ухудшать качество изображения. Установленные непосредственно на корпусе микроскопа, диски со светофильтрами и затворы во время работы способны создавать вибрации, которые могут длиться сотни миллисекунд. Это обстоятельство может серьезно снизить разрешение изображений.
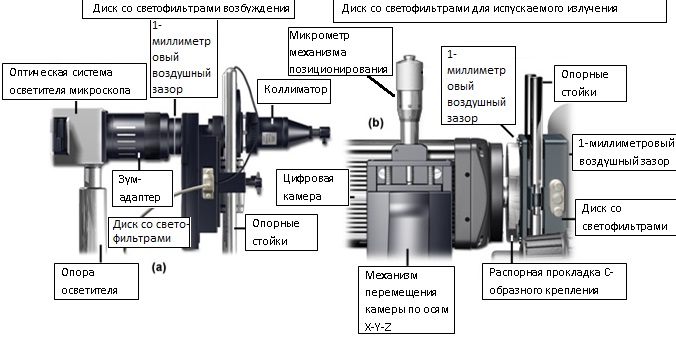
Рис. 3.Конфигурации дисков со светофильтрами и затворов для ослабления вибрационных искажений
Проблемы вибрации присущи и серийно выпускающимися микроскопами научно-исследовательского уровня, которые могут содержать целый ряд моторизированных компонентов. Стремясь уменьшить такие вибрации, производители часто ограничивают скорость работы навесных устройств (приводов координатных перемещений, револьверных держателей и конденсоров), либо вводят задержку по времени между моментом остановки двигателя и началом формирования изображения. К сожалению, во многих случаях такие задержки снижают общее быстродействие системы и часто подвергают образец ненужному облучению чрезмерным количеством света. Производители также расширяют номенклатуру своих изделий, включая в нее автоматические затворы, диски для светофильтров, кубические блоки с флуоресцентными фильтрами, контроллеры портов и родственные принадлежности, с управлением всеми перечисленными устройствами от одного контроллера. Эти периферийные устройства позволяют быстро, автоматически переключаться из одного режима наблюдения в другой, и идеально подходят к микроскопам, конфигурированным для визуализации живых клеток. Из числа новых опций предлагается парфокальная компенсация — для согласования фокусной точки при смене объективов, средства регулировки чувствительности — для механизмов тонкой фокусировки и координация автоматических функций — для обеспечения бесперебойного выполнения запрограммированных временных последовательностей.
Большая часть находящихся в эксплуатации микроскопов предыдущих поколений не позволяет реализовывать преимущества новейших автоматических периферийных устройств, и владельцы таких микроскопов вынуждены полагаться на вторичный рынок запчастей. При использовании вспомогательных устройств целесообразно установить блок осветителя, диски для светофильтров и затворы на отдельную от микроскопа стойку, чтобы исключить вибрации и реализовать синхронизацию устройств без необходимости введения временнóй задержки. В большинстве случаев, сложность подсоединения периферийных устройств требует прецизионной юстировки компонентов.
Поэтому, лучше всего установить всю систему на изолированном от вибраций столе или на оборудованной амортизаторами лабораторной платформе. Такие платформы с резьбовыми отверстиями, расположенными с интервалом в 1 дюйм, имеются в продаже. На рисунке 3 представлены рекомендуемые конфигурации диска со светофильтрами и затвора, предназначенные для уменьшения вибрационных искажений. Все, показанные на рисунке, детали прочно закреплены на лабораторной панели или на изолирующем столе. С целью снижения вибрационного воздействия диск со светофильтрами отделен от микроскопа и цифровой камеры воздушными зазорами шириной 1 мм. Коллиматор осветителя на рисунке 3(a) соединен непосредственно с затвором, заключенным в кожух диска со светофильтрами, и опирается на алюминиевые стойки. Зазор между затвором и масштабирующим переходником предотвращает нарушение равновесия микроскопа быстрыми движениями створок затвора. Аналогично, диск для светофильтров в конфигурации, представленной на рисунке 3(b), также отделен от штатива микроскопа и от камеры воздушным зазором.
При установке диска со светофильтрами на порт испускаемого излучения микроскопа предыдущего поколения, возникает еще одна проблема. Эта проблема заключается в потенциальном нарушении парфокальности, отклонения от выбранной полосы пропускания (волн соответствующей длины) и возникновения аберраций из-за введения плоских оптических пластин в выходящий из микроскопа сфокусированный световой поток. . Установка фильтра излучения в выходной световой пучок микроскопов некоторых конфигураций может вызывать сдвиг фокальной плоскости. Степень такого сдвига зависит от толщины и показателя преломления устанавливаемого фильтра. Кроме того, проходя через полосовой интерференционный фильтр под различными углами, сфокусированный световой поток может вносить изменения в значение центральной длины волны полосы пропускания (зоны прозрачности) для различных составляющих светового потока. Эти смещения легко компенсируются дополнительными адаптерами, которые создают коллимированное пространство (бесконечность) в порту (микроскопа) для испускаемого излучения, что позволяет устанавливать диски со светофильтрами и другие оптические устройства в параллельный, создаваемый адаптером путь прохождения света.
В качестве альтернативы дискам со светофильтрами были разработаны системы, позволяющие получать цветные изображения или выполнять спектральное разделение одновременно с линейным разделением, без смены светофильтров и с использованием одного фотоприемника цифровой камеры. Преимущество таких систем состоит в исключении искажений, связанных с движущимися деталями, которые часто возникают при использовании дисков со светофильтрами во время последовательной съемки, а также в обеспечении превосходной регистрации изображений. Многоканальные системы весьма удобны для проведения количественных экспериментов с многоцветной визуализацией (таких, как резонансный перенос энергии), где искажение в регистрации сигнала всего лишь одной ячейки (пикселя) может привести к значительным ошибкам. К недостаткам таких систем можно отнести ограниченную пропускную способность фильтра и сокращение эффективной, формирующей изображения области датчика, которая уменьшается наполовину или на четверть (в зависимости от конфигурации внутреннего светоделителя и пропускной способности фильтра). В новых многоканальных системах пространственные ограничения частично устранены за счет разделения и направления светового потока на два раздельных фотоприемника (цифровые камеры), каждый из которых оборудован независимым фильтрующим каналом и системой тонкой фокусировки, для обеспечения уверенной регистрации пикселей.
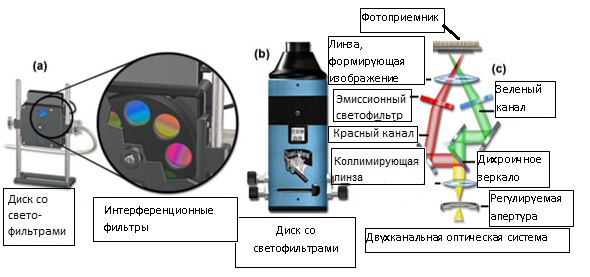
Рис. 4. Конфигурация двухканальной системы получения изображений с дисками со светофильтрами
Представленные на рисунке 4 устройства для переключения длин волн работают по принципу вращения диска со светофильтрами и установки на оптическом пути света нового интерференционного фильтра (рисунок 4(a)), либо по принципу направления испускаемого света по отдельным оптическим путям (рисунки 4(b) и 4 (с)). На рисунке 4(a) представлен стандартный диск, вмещающий до 10 отдельных светофильтров. Диск управляется внешним устройством (не показано) и способен переключать систему с одного фильтра на другой в течение 25 — 40 миллисекунд. К преимуществам таких дисков можно отнести возможность быстро менять наборы фильтров и бесчисленные конфигурационные возможности, как для возбуждающего, так и для испускаемого светового излучения. На рисунке 4 (с) представлена оптическая система двухканального устройства визуализации (рисунок 4(b)). Такие многоканальные системы для получения изображений пользуются растущей популярностью, в качестве альтернативы дискам со светофильтрами, и подробно описаны в последующих разделах.
Многоканальные системы визуализации коллимируют и пропускают световой поток выходного порта микроскопа через одиночное дихроичное зеркало, которое расщепляет падающий луч на две независимые и спектрально различные составляющие (лучи) (см. рисунок 4 (с)). Один из лучей содержит волны с длинами, меньшими, а второй — с большими, чем «точка отрезания» зеркала. Два полученных луча проходят через оптическую систему, и могут быть скорректированы в отношении спектрального состава, интенсивности и поляризации путем пропускания через соответствующий фильтр. После фильтрации лучи проходят через общую линзу-формирователь изображений, и создают на воспринимающей поверхности фотоприемника два пространственно разделенных и спектрально различных изображения. Каждое из изображений проецируется на половину матрицы фотоприемника. В системах, разделяющих исходный световой поток на четыре луча, одиночное дихроичное зеркало заменяется зеркалом с тремя полосами пропускания. В остальном, система работает аналогично двухканальной.
Изменив конструкцию, выходные лучи многоканальной системы можно направить на две камеры (как уже упоминалось), и получить два изображения, используя всю матрицу фотоприемника, в тех случаях, когда требуется полное поле зрения. Объединенную со щелевой системой и автоматически перемещаемым предметным столиком, многоканальную систему можно адаптировать для исследований со спектральной визуализацией. Одно из главных преимуществ многоканальных систем визуализации состоит в отсутствии задержек при получении изображений и потенциальных проблем с вибрацией, создаваемой вращающимся диском со светофильтрами. Таким образом, любая задержка, связанная с получением изображений, обусловлена ограничениями, накладываемыми скоростью считывания, которой обладает фотоприемник. В сочетании с электронно-умножающими камерами (EMCCD), способными на высокоскоростное считывание при очень низких уровнях освещенности, многоканальные системы получения изображений дают возможность регистрировать внутриклеточные явления, протекающие за значительно меньшие промежутки времени, чем те, которые позволяют регистрировать дисковые системы со светофильтрами.
Визуализация живых клеток в конфокальной и многофотонной микроскопии ограничивается спектральными линиями излучения лазерной системы, подключенной к прибору. В конечном итоге, принцип селекции длин волн в широкопольной микроскопии, в системах с вращающимися дисками и разверткой поля, а также во флуоресцентной микроскопии полного внутреннего отражения (TIRF белого света) может привести, по меньшей мере, в большинстве самых передовых приложений, к переходу от полосовых интерференционных фильтров к перестраиваемым монохроматорам, жидкокристаллическим (LCTF) и акустооптическим (AOTF) фильтрам. В монохроматорах для оптической микроскопии используется комбинация дуговой лампы (обычно, ксеноновой), частотно-селективной пластины на базе дифракционной решетки и конденсорной системы осветителя, направляющей свет в микроскоп (см. рисунок 8(d)). Контролируемые быстродействующими гальванометрами, управляющими положением входной щели и дифракционной решетки, эти устройства способны за миллисекунды и с прецизионной точностью изменять длину волны и полосу пропускания. Жидкокристаллические перестраиваемые фильтры (LCTF) характеризуются высокой разрешающей способностью, апертурой большого диаметра, отсутствием ошибок регистрации изображений и приемлемой скоростью, и могут применяться в исследованиях со спектральной визуализацией. С другой стороны, ЖК перестраиваемые фильтры обладают ограниченным спектральным диапазоном, неустойчивыми полосами пропускания, низким светопропусканием (обычно, 30% на фильтр) и требуют удлинения оптического пути. Акустооптические перестраиваемые фильтры являются «рабочей лошадкой» для частотной селекции в конфокальной микроскопии, но пока не нашли широкого применения в других режимах визуализации. Прежде, чем эти устройства можно будет повсеместно использовать для визуализации живых клеток при помощи широкопольных флуоресцентных микроскопов, необходимо устранить такие их недостатки, как узкая полоса пропускания, низкая разрешающая способность, размывание изображения и т. д.
Механизм фокусировки и перемещения предметного столика
Двигатели механизмов фокусировки соединяются с редуктором механизма, который, под управлением компьютерной программы получения изображений, автоматически осуществляет точную фокусировку микроскопа. Эти устройства можно использовать совместно с программными функциями автоматической фокусировки, либо для получения набора оптических срезов для последующего деконволюционного анализа и/или воссоздания трехмерного изображения. Моторизированные предметные столики, используемые совместно с программным обеспечением (ПО) для визуализации, можно автоматически перемещать из одного поля обзора в другое, либо между лунками чашки для культивирования. Чтобы получить набор изображений осевых срезов (так называемую z-серию изображений), механизм тонкой фокусировки объектива микроскопа должен, под управлением ПО для визуализации, пошагово и с прецизионными интервалами переместить фокальную плоскость через весь образец. Производители микроскопов и дополнительного оборудования предлагают множество различных моторизированных ступенчатых (шаговых) устройств фокусировки, которые перемещают целиком весь револьвер объективов либо предметный столик микроскопа. В качестве альтернативы, в револьверном держателе можно установить пьезоэлектрическое устройство, которое будет перемещать вверх и вниз вдоль оптической оси микроскопа только один объектив. Основным преимуществом шаговых двигателей является их дешевизна и практически неограниченная длина перемещения рабочего органа, что обеспечивает дополнительные возможности контроля над процессом получения «стопок» изображений. Кроме того, поскольку шаговые двигатели предназначены для использования с редуктором приводного механизма микроскопа, они позволяют автоматически фокусировать любой из объективов, установленных в револьверном держателе. Основным недостатком шаговых двигателей, в сравнении с пьезоэлектрическими устройствами, является меньшее быстродействие и значительно больший гистерезис. Самый высокоскоростной метод получения z-последовательностей обеспечивают пьезоэлектрические устройства, обладающие большей точностью и скоростью, нежели шаговые двигатели. Однако, пьезоэлектрические приводы имеют ограниченное расстояние перемещения (100 — 200 микрон) и более высокую стоимость.
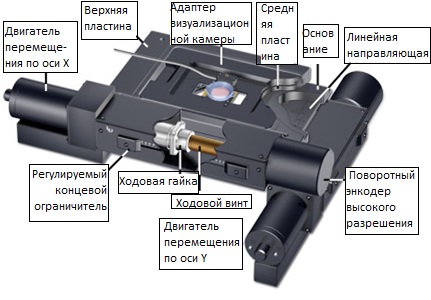
Рис. 5. Конструкция прецизионного моторизированного предметного столика
На рисунке 5 представлен высококачественный моторизированный предметный столик с камерой для визуализации живых клеток. Моторизированные столики очень удобны для компенсации поперечного дрейфа и получения последовательных изображений двух и более полей обзора во время выполнения последовательности съемки в заданные моменты времени. Сегодня рынок предлагает моторизированные предметные столики с шаговыми двигателями постоянного тока (DC) или с серводвигателями. Серводвигатели, обычно, обладают бóльшими скоростями перемещения, чем шаговые (зачастую, в два раза). Возможность точно контролировать положение (и его повторяемость) предметного столика зависит от системы обратной связи с кодовым датчиком положения (энкодером). Этот же датчик определяет разрешение при перемещении предметного столика. Основное преимущество шаговых двигателей, в сравнении с серводвигателями, состоит в надежности и превосходном управлении на малых скоростях. Диапазон перемещения стандартного предметного столика составляет 2 — 4 дюйма в обоих направлениях — x и y. Энкодеры большинства предметных столиков обладают разрешающей способностью от 40 до 100 нанометров и обеспечивают повторяемость (способность возвращаться в ранее занимаемое положение) от 300 до 750 нанометров. В большинстве своем, моторизированные предметные столики позволяют устанавливать на них весь спектр держателей образцов, в том числе многолуночные пластины, колбы, чашки Петри и стандартные предметные стекла для микроскопов. Кроме того, на многие предметные столики можно устанавливать адаптеры камер с контролируемой окружающей средой для визуализации живых клеток. Для моторизированных предметных столиков требуется отдельное устройство управления (контроллер), которое, обычно, оснащается манипулятором (джойстиком) для управления координатным перемещением. Этот контроллер может быть выполнен в виде автономного устройства, либо работать под управлением главного компьютера (через интерфейсы RS-232 или USB) в единой системе вспомогательных устройств.
Одной из наиболее серьезных и часто встречающихся проблем в микроскопии с получением изображений живых клеток в течение заданного интервала времени, являются флуктуации положения фокальной плоскости микроскопа по оси. Часто называемое дрейфом фокусировки, изменение положения фокальной плоскости микроскопа обусловлено, обычно, колебаниями температуры в камере для образца или в помещении, где установлен микроскоп. Сегодня производители микроскопов и дополнительного оборудования предлагают целый ряд программных и аппаратных средств для борьбы с дрейфом фокусировки. Одними из аппаратных средств являются системы автоматической фокусировки, основанные на принципе измерения расстояния между передней линзой объектива и образцом за счет обнаружения световых или звуковых колебаний, отраженных от нижней поверхности покровного стекла (ближайшей к объективу поверхности). Однако, при использовании иммерсионных объективов с высоким разрешением, этот метод может оказаться неработоспособным из-за потери контрастности и отражательной способности при прохождении света (из системы измерения расстояния) через масло. В наиболее современных системах автоматической фокусировки в качестве источника излучения используется лазер низкой интенсивности ближнего инфракрасного диапазона или светоизлучающий диод (СИД). Излучение от такого источника направляется через объектив на верхнюю поверхность покровной пластины (сторона с клетками, погруженная в культуральную среду), отражается от этой поверхности, после чего собирается объективом и направляется на фотоприемник системы (цепи обратной связи), управляющей положением объектива относительно границы раздела «покровное стекло-культуральная среда».
Предлагаемые сегодня системы автоматической фокусировки способны компенсировать дрейф фокусировки, обусловленный флуктуациями температуры (см. выше), плотности и вязкости иммерсионной среды, а также вибрациями. Наиболее совершенные системы работают по принципу непрерывного сравнения получаемого изображения и текущего аксиального (продольного) положения со сформированным в процессе настройки эталонным изображением. В качестве эталона, обычно, берется полученный от покровного стекла рисунок отражений, интенсивность которого легко измерить при помощи специальной сенсорной схемы. Система контроля аксиального положения компенсирует температурный и механический дрейф и перемещает покровное стекло в первоначальную фокальную плоскость, обеспечивая точную фокусировку («резкий фокус» или «резкость»). Оператор может определить характерное значение (называемое смещением) для требуемой аксиальной фокусировки, которая часто отклоняется от точного положения границы между покровным стеклом и водной культуральной тканевой средой или буферным раствором. Системы автоматической фокусировки способны корректировать дрейф фокусного расстояния за миллисекунды — очевидное преимущество над программно-реализованными алгоритмами, которые для этого, зачастую, требуют нескольких секунд (и могут приводить к значительным уровням фототоксичности и фотообесцвечивания).
При оценке систем автоматической фокусировки, среди прочих параметров, следует рассмотреть их способность обрабатывать сложное изображение с множеством деталей, находящихся в нескольких аксиальных и латеральных положениях на одном образце. Не менее важными характеристиками являются частота и точность коррекции фокусировки, а также режим работы — непрерывная компенсация, или же коррекция непосредственно перед съемкой каждого изображения. Каждый подход обладает своими преимуществами. Для наблюдений в реальном времени больше подходят системы с постоянной обратной связью, нежели те, которые работают независимо от программного запроса. Однако, когда главной целью эксперимента является получение изображений, предпочтительно включать систему автофокусировки непосредственно перед получением снимка, по причине жесткой необходимости синхронизировать получение снимка с определением опорной точки (выполняется при каждой оценке фокусировки, с целью определения наличия или отсутствия дрейфа). В экспериментах со съемками в заданные моменты времени, когда между получением снимков проходит значительное количество времени, короткий промежуток, необходимый для измерения положения фокальной точки, не имеет значения. С другой стороны, при высокоскоростной съемке (от 2 до 30 кадров в секунду) последовательностей изображений, системы автофокусировки могут создавать искажение под названием дрожание. Это искажение возникает вследствие попытки системы автофокусировки скорректировать фокусировку путем самопроизвольного перемещения предметного столика во время получения снимка.
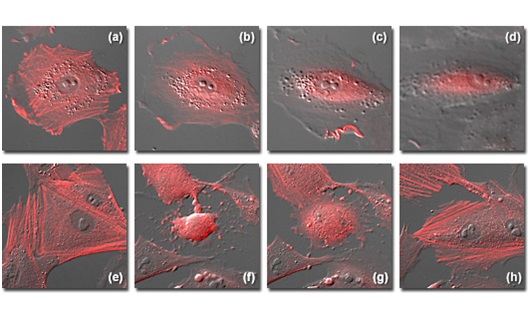
Рис. 6. Преимущества использования систем автофокусировки при получении изображений в заданный временной интервал
Рисунок 6 демонстрирует преимущества системы автоматической фокусировки на примере получения последовательности изображений в ходе длительного эксперимента, со съемкой в заданные моменты времени. Каждый из кадров последовательности представляет интервал в 4 часа. Образец — клетки фибробласта легкого серой лисицы (линия FoLu), стабильно трансфецированные beta-актином человека, слитым с флуоресцентным белком mCherry. Флуоресцентно окрашенный актин концентрируется в стрессорных волокнах цитоскелета. Видно, что клетка на рисунках 6(a) — 6(d) медленно выходит (дрейфует) из фокуса вследствие температурных флуктуаций, возникающих в течение 16-часовой последовательности в режиме съемки в заданные моменты времени. Яркие и четко видные стрессорные волокна (рисунок 6(a)) по мере дрейфа фокусировки становятся менее определенными (рисунок 6(b)), пока не остаются различимыми только окрашенный актин в цитоплазматических волнах (раффлах) и цитозольный пул (рисунки 6© и 6(d)). Напротив, с использованием автоматической фокусировки видно, как диспергируют «резкие» стрессорные волокна (рисунок 6(e)) при вхождении центральной клетки поля зрения в метафазу (рисунок 6(f)), но снова появляются, когда дочерние клетки присоединяются к покровному стеклу и растекаются по нему (рисунки 6(g) и 6(h)). Сохранение фокусировки, в процессе сбора протяженных по времени последовательностей изображений, часто является главным фактором успеха эксперимента
Одним из заключительных аспектов оценки систем автофокусировки является суммарное время, в течение которого необходимо получать изображения; это могут быть секунды, часы и даже дни. В ходе длительных экспериментов, работе систем с непрерывным контролем (с постоянно работающей обратной связью) может препятствовать механический дрейф, вызванный гистерезисом, или «сползание», возникающее из-за помех в пьезоэлектрических приводах. Для краткосрочных исследований эти проблемы несущественны, но могут стать весьма серьезными при долгосрочном получении изображений. Обе вышеупомянутые проблемы могут осложняться при использовании объективов с высокой числовой апертурой (и увеличением), малая глубина фокусировки (резкости) которых требует строгого контроля и высокой точности. Независимо от возможных помех, создаваемых системами автоматической фокусировки, они вносят неоценимый вклад во флуоресцентную высокоразрешающую микроскопию живых клеток.
Источники освещения для получения изображений живых клеток
Традиционно в осветительных системах для широкопольной микроскопии в качестве источников освещения используются галогенные лампы с вольфрамовой нитью накаливания (для режима проходящего света) и газоразрядные лампы с короткой дугой (для возбуждения флуоресценции). Что касается лазеров, то в качестве источников для широкопольных микроскопов они используются весьма ограниченно. Однако, широкое распространение конфокальных и многофотонных микроскопов значительно повысило степень использования лазеров в оптической микроскопии. Поскольку, едва ли не одним из самых важных параметров для получения данных при визуализации живых клеток является отношение «сигнал/шум», камеру для образца необходимо освещать с высокой интенсивностью, чтобы достичь максимального уровня сигнала и полного разрешения оптической системы.
Однако, будучи сфокусированной на полной мощности через объектив со 100-кратным увеличением и числовой апертурой 1,4, 100-ваттная ртутная дуговая лампа, всего лишь за несколько секунд наносит серьезный ущерб жизнеспособности клеток млекопитающих. Аналогичные повреждения, только медленнее, получают клетки млекопитающих, когда на полной мощности освещаются вольфрамово-галогенной или ксеноновой лампой. А лазер высокой мощности может разрушить такие клетки даже быстрее, чем ртутная лампа. Следовательно, интенсивность и спектральный состав света, воздействующего на образец, необходимо тщательно регулировать. В экспериментах по визуализации живых клеток следует использовать только ограниченные, действительно необходимые для исследования, области спектра (для освещения флуорофора, фотоактивации, фотообесцвечивания и т. д.). Практически во всех ситуациях, ограничения уровней освещения и диапазонов излучения представляют собой компромисс между качеством изображения и поддержанием жизнеспособности клеток.
Один из наилучших критериев для определения чрезмерно высокой интенсивности освещения состоит в том, входят ли клетки в условиях эксперимента в фазу митоза и завершают ли его. Некоторые клетки, например, эмбриональные, относительно устойчивы к видимому свету, возможно, потому, что у них отсутствует остановка цикла деления как реакция на повреждение ДНК. Однако, многие из наиболее популярных линий клеток млекопитающих, включая клетки кенгуровой крысы, почки свиньи и индийского мунтжака, а также наиболее популярные культуры, чрезвычайно чувствительны к свету. Независимо от используемого для эксперимента источника света, в оптическую систему необходимо устанавливать светофильтры, чтобы предотвратить наличие в освещении даже ничтожных количеств ультрафиолетового и инфракрасного излучения.
Несмотря на то, что широко использующиеся для получения флуоресцентных изображений современные полосовые фильтры обладают высокими уровнями блокировки в видимой части спектра, им все же свойственно пропускать некоторые количества самых коротковолновых и длинноволновых излучений. Поэтому, целесообразно установить на пути лучей недорогие стеклянные фильтры, чтобы блокировать излучение по краям спектрального диапазона видимого света. Такие дополнительные фильтры особенно важны при использовании ртутных дуговых ламп, поскольку последние создают очень высокие уровни ультрафиолетового излучения. Вольфрамово-галогенные лампы излучают большие количества инфракрасных волн, вследствие чего требуют применения инфракрасных фильтров во всех экспериментах с живыми клетками. Ксеноновые лампы, напротив, излучают намного меньше ультрафиолета, но имеют пики излучения в ближней инфракрасной области. Набирающие популярность металлогалоидные лампы формируют спектр, аналогичный спектру ртутной лампы, но с большей интенсивностью в длинноволновой части.
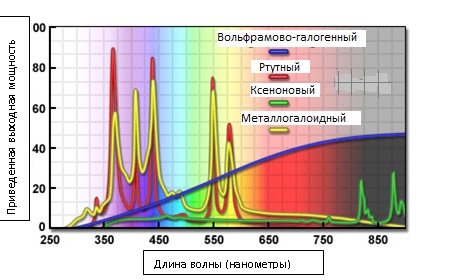
Рис. 7. Спектральные характеристики распространенных источников света
На рисунке 7 представлены спектральные профили некоторых источников освещения, широко использующихся для визуализации живых клеток. Отдельные пики в спектрах излучения ртутных и металлогалоидных ламп рассматриваются ниже. Вольфрамово-галогенная лампа сравнительно мало излучает в ультрафиолетовой области спектра, но интенсивность ее излучения постепенно возрастает, прежде чем установиться практически на постоянном уровне в ближней инфракрасной области. В центре видимого диапазона (550 нанометров) выходная мощность лампы накаливания составляет около 25% от выходной мощности ртутной дуговой лампы. В отличие от ртутной, ксеноновая дуговая лампа обладает низкой выходной мощностью в видимой части спектра, — основная часть ее энергии приходится на излучение с длиной волны более 800 нм. Однако, в видимой части спектра профиль выходной мощности излучения ксеноновой лампы намного более плавный, чем у ртутной и металлогалоидной ламп. Все, представленные на рисунке 7, источники света находят широкое применение в сфере визуализации живых клеток.
Наиболее распространенным источником освещения для визуализации клеток с использованием методов улучшения контрастности в режиме светлого поля (преимущественно, ДИК, HMC и фазового контраста), является 100-ваттная галогенная лампа с вольфрамовой нитью накаливания (вольфрамово-галогенная лампа). Во время длительных экспериментов в нормальных условиях эксплуатации эта лампа особенно стабильна, и подвержена только незначительным флуктуациям интенсивности (пространственным и временным). С целью повышения временнóй стабильности для проведения экспериментов с получением изображений в заданные интервалы времени, когда в течение длительного периода времени делаются сотни или даже тысячи снимков, систему можно оборудовать стабилизированным источником электропитания. Как правило, такая мера требуется только для лабораторных условий, где нередки падения сетевого напряжения. Использование зеленого или красного светофильтра для блокировки ультрафиолетовой и синей составляющих спектра в режимах светлопольного получения изображений, с целью сохранения жизнеспособности клеток, снижает суммарную интенсивность освещения. Во многих случаях, для дифференциально-интерференционного и фазового контраста используется зеленый интерференционный светофильтр на длину волны 546 нм, но более длинноволновые фильтры работают, как правило, так же хорошо. Следует отметить, что с современными флюоритовыми и апохроматическими объективами больше не нужно использовать зеленый интерференционный светофильтр для классической коррекции хроматической аберрации при получении изображений в режимах светлого поля.
Вообще говоря, при визуализации в режиме светлого поля следует выбирать тот диапазон излучения источника освещения, который менее всего вреден для образца. В результате обширных исследований выявлено, что в большинстве своем, клетки обладают слабой устойчивостью к ультрафиолетовому и инфракрасному излучению, и менее всего чувствительны к красному, зеленому и синему свету (в порядке возрастания чувствительности). Таким образом, с биологической точки зрения целесообразно, где это возможно, использовать для исследований живых клеток красный свет (с длиной волны 600 — 650 нм), несмотря на то, что с увеличением длины волны ухудшается разрешение, а некоторые ПЗС-камеры менее чувствительны к излучению из этого диапазона. Разрешающая способность менее важна, нежели жизнеспособность клеток, да и ограничивается разрешение, в большей степени, внутриклеточными движениями, дрейфом температуры и дефектами оптической и осветительной систем. Ограничения чувствительности фотокамер быстро стали объектом пристального внимания производителей, которые стараются создавать изделия с более равномерной чувствительностью во всей видимой области спектра.
Плазменные источники с короткой дугой обладают наибольшей яркостью и интенсивностью излучения из всех непрерывно работающих источников света, и очень близки к модели идеального точечного источника света. Однако, дуговым лампам свойственны значительно бóльшие флуктуации интенсивности, чем лампам накаливания (вольфрамово-галогенным), в силу того, что газоразрядная плазма по своей природе неустойчива и подвержена влиянию магнитных полей и эрозии электродов. Главное влияние на кратковременную стабильность оказывают три артефакта дуги, создаваемые между вольфрамовыми электродами. Мерцание дуги возникает тогда, когда точка соединения дуги с коническим кончиком катода кругообразно перемещается по поверхности электрода; полный круг дуга описывает, обычно, за несколько секунд. Вспышка — этим термином обозначается мгновенное изменение яркости в результате перемещения дуги в новое место на катоде, обладающее бóльшим эмиссионным качеством, чем предшествующая точка присоединения дуги. Конвекционные потоки в газообразном ксеноне или в парах ртути, обусловленные разностью температур между дугой и баллоном создают флаттер (пульсирующие колебания) дуги, проявляющийся в виде быстрого поперечного смещения ее столба. Металлогалоидные дуговые лампы, помимо ртути, содержат галогены, в частности, йод и бром, и работают по принципу, известному как вольфрамово/галлоидный цикл, когда галогены препятствуют оседанию на стенках баллона испаряющегося с электродов вольфрама, и тем самым, продлевают срок службы и повышают устойчивость работы лампы. Сегодня эти источники света находятся среди наиболее предпочитаемых во флуоресцентной микроскопии.
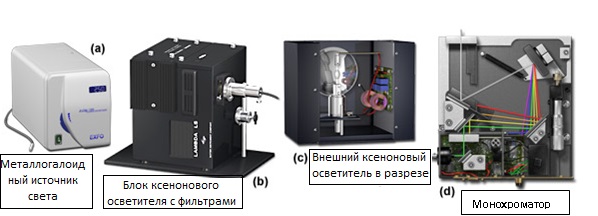
Рис. 8. Высококачественные осветители для визуализации живых клеток
Только 45% излучения стандартной ртутной лампы (HBO; 100 ватт) приходятся на пригодный для флуоресцентной микроскопии диапазон (от 350 до 700 нанометров). Более того, бóльшая часть энергии излучения такой лампы сконцентрирована в отдельных спектральных линиях: 366 нм (10,7%), 436 нм (12,6%), 546 нм (7,1%) и 579 нм (7,9%). Хотя в диапазоне 350 — 700 нм полезная выходная мощность ксеноновой лампы (XBO; 75 ватт) распределяется сравнительно равномерно, но составляет всего лишь 24,5% от общей излучаемой мощности, а бóльшая часть энергии (приблизительно, 74%) приходится на ближний инфракрасный диапазон. Ксеноновые дуговые лампы часто используются в тех случаях, когда требуется широкий диапазон возбуждающего излучения. По спектральному распределению выходной мощности излучение ксеноновой лампы аналогично солнечному свету, поскольку обеспечивает равномерную интенсивность, без заметных пиков, в видимом и ультрафиолетовом диапазонах.
На рисунке 8 представлены некоторые, наиболее совершенные из имеющихся сегодня в продаже источников освещения для визуализации живых клеток. Металлогалоидная лампа (рисунок 8(a)) быстро становится одним из самых распространенных источников освещения для широкопольной микроскопии, и часто используется для замены ртутной дуговой лампы. Внешние ксеноновые осветители (рисунки 8(b) и 8©) обычно соединяются с коллиматором (установленным во входном порту микроскопа) одномодовым волоконным или жидкостным световодом. Наиболее универсальным источником освещения является монохроматор (рисунок 8(d)). Он позволяет выбирать конкретную длину волны возбуждающего излучения, но является, также, и самым дорогим вариантом. Как правило, в монохроматоре используется ксеноновая, или аналогичная дуговая лампа. Конструкция монохроматора, за счет смены светофильтров освещения и возбуждающего излучения, позволяет чрезвычайно быстро выбирать длину волны для флуоресцентной микроскопии. В совокупности, представленные на рисунке 8 источники освещения, предоставляют пользователю широкий диапазон выбора, соответствующий любому бюджету.
Много усилий было затрачено на синтез флуорофоров, имеющих максимумы поглощения вблизи пиковых спектральных линий излучения ртути. Например, классические зонды — родамин и MitoTracker Red, с высокой эффективностью поглощают излучение с длиной волны, соответственно, 546 нм и 579 нм (одни из пиковых линий спектра излучения ртути), а максимумы поглощения серии красителей Alexa Fluor соответствуют большинству пиков спектра излучения ртути (350 нм, 405 нм, 440 нм, 546 нм и 568 нм). На протяжении многих лет дуговые ртутные лампы были самыми распространенными источниками света для флуоресцентной микроскопии. Но, как уже упоминалось, они не обеспечивают равномерное поле освещения и демонстрируют сильные кратковременные флуктуации выходной мощности. Оба этих недостатка могут создавать серьезные проблемы для количественного анализа флуоресценции. Спектр излучения металлогалоидных ламп похож на спектр излучения ртутных ламп HBO, но, помимо этого, имеет, примерно, на 50% более мощные непиковые интенсивности. Поэтому, те флуорофоры, которые не демонстрируют заметное возбуждение спектром излучения ртутной лампы, например, флуоресцеин и Alexa Fluor 488, при освещении металлогалоидными источниками дают более яркие изображения. Кроме того, плотность потока излучения металлогалоидных ламп намного более равномерна, что очень легко обнаруживается при использовании цифровых камер. Ксеноновые лампы, хотя и менее ярки, также более стабильны, чем ртутные, и обеспечивают практически постоянную освещенность для флуорофоров во всем видимом диапазоне спектра. Для решения проблемы неоднородной освещенности при использовании дуговых ламп, можно соединить блок осветителя со входным портом микроскопа, уже упоминавшимся жидкостным световодом. За счет рассеяния проходящего через него света, световод создает более равномерное световое поле. Флуктуации выходной мощности во времени более трудно контролировать; наиболее успешными являются механизмы с использованием обратной связи, контролирующие параметры электропитания (потребляемую мощность) лампы.
Как правило, микроскопы, использующиеся для визуализации живых клеток в проходящем и флуоресцентном свете работают в режиме освещения по схеме Келера. Эта универсальная схема предназначена для равномерного освещения поля изображения специальным пространственно- комплексным источником (дуговыми или вольфрамово-галогенными лампами), за счет изображения только части источника в фокальной плоскости конденсора — в режиме проходящего света, или же в задней фокальной плоскости объектива — в режиме флуоресценции с эпископическим освещением. Падающий на источник свет равномерен, хотя и не может поступать с одинаковым распределением при различных возможных углах падения. Полевая диафрагма (которая, фактически, лежит в промежуточной плоскости изображения) проецируется на образец, с целью ограничить освещаемую область без изменения угла падения освещающего излучения. Для усиления однородности освещения в фокальной плоскости, в случае очень неоднородных источников можно использовать диффузионный фильтр. Схема освещения по Келеру не является самой эффективной, поскольку не использует всю поверхность источника и полное угловое распределение излучаемого света. Однако, для микроскопов, оборудованных только таким осветителем, который излучает свет непосредственно в конденсор, освещение по Келеру остается наилучшим вариантом юстировки микроскопа.
Помимо того, что метод освещения по Келеру предназначен для обеспечения равномерного освещения и контроля его когерентности, использование световода дает возможность достичь однородности освещения. Преобразование света, эффективно снижающее его когерентность в пространстве или во времени, также достигается за счет применения световодов. Наиболее широко использующийся и практичный метод подсоединения источника света к микроскопу, одновременно снижающий когерентность, состоит в сфокусированном направлении света в одномодовое оптоволокно или в жидкостный световод (см. рисунок 9). Тепловое движение в жидкостном световоде непрерывно изменяет оптический путь пучка и рассеивает его, эффективно устраняя пространственную и временную когерентность. Поскольку волокно слегка изгибается, векторы отражения от оболочки спирального одномодового оптоволокна непрерывно изменяются, формируя выходной пучок, фактически однородный по интенсивности во времени и в пространстве. Кроме того, эффективно скремблирует свет вибрация оптоволокна (с частотой до 100 килогерц). Скремблирование фазы светового излучения происходит за счет различных длин оптических путей, по которым световые волны проходят через оптоволокно, хотя высокая интенсивность и монохроматичность, при этом, сохраняются. Выходной пучок имеет скорее цилиндрический, а не гауссов профиль распределения интенсивности, характерный для лазерного излучения. Во избежание теплового повреждения оптического преобразователя, следует удалить из светового пучка инфракрасную, а также другие нежелательные составляющие, прежде, чем они попадут в оптоволоконный или жидкостный световод. В идеальном случае, из источника освещения должны выходить только те спектральные составляющие, которые важны для формирования изображения (кривые пропускания оптоволоконного и жидкостного световодов представлены на рисунке 9). Для селекции световых волн, которые будут проходить к апертурному диску, и для отвода нежелательного тепла следует использовать не широкополосные, а холодные (отражающие видимое и пропускающие ИК-излучение) зеркала и полосовые интерференционные фильтры.
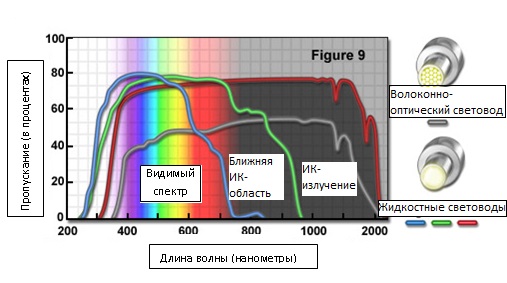
Рис. 9. Кривые пропускания оптоволоконного и жидкостного световодов
Критической проблемой использования жидкостных или волоконно-оптических световодов в микроскопии является эффективность подсоединения внешних осветителей. Числовая апертура большинства оптических волокон лежит в диапазоне 0,2 — 0,55, и это значение необходимо согласовать с оптикой, собирающей излучение источника. Некоторые производители выпускают осветители, предназначенные для работы с жидкостными световодами, в которых это условие соблюдено. Сочетание 75-ваттной ксеноновой лампы в эллиптическом рефлекторе, холодного зеркала и оптически согласованного жидкостного световода, диаметром 3 — 5 миллиметров, может обеспечить световой выход более 2 милливатт на нанометр. Независимо от размера дуги лампы, конец световода становится эффективным источником света для микроскопа, с меньшей, чем у собственно дуги, интенсивностью. Однако, когда цель состоит в равномерном освещении апертуры большого диаметра, как в случае конфокального микроскопа с вращающимся диском, протяженный источник не столь вреден для характеристик системы. Единственное требование заключается в наличии коллимирующей линзы с диаметром, достаточным для того, чтобы эффективно собрать световой поток на выходе световода и спроецировать его на дисковый сканер.
В конфокальной микроскопии с вращающимися дисками используется такой механизм сканирования, при котором освещение заполняет заднюю апертуру объектива. Передача всего излучаемого источником света на образец представляет собой некий случай, более характерный для не лазерных систем, поскольку излучение таких источников, как дуговые лампы, представляет, скорее, сферу, а не параллельный пучок. Следовательно, чтобы направить на образец свет от тыльной стороны дуги, необходим рефлектор. Ненужные составляющие спектра, например, ультрафиолет и ИК-излучение, можно пропустить через дихроичные зеркала (инфракрасный излучатель обозначается термином холодное зеркало, а ультрафиолетовый — горячее зеркало), — они будут поглощены в блоке осветителя. Рассеяние тепла холодным зеркалом уменьшает перемещение источника, вызванное тепловым расширением механических и оптических компонентов. В микроскопии всех типов линзы, находящиеся вблизи источников тепла, необходимо устанавливать с учетом теплового расширения. Рынок вспомогательного оборудования предлагает широкий выбор осветителей, в которых внешний источник света (обычно, ксеноновый или металлогалоидный) соединяется с микроскопом волоконно-оптическим или жидкостным световодом (см. рисунок 8). Кроме того, для прецизионной частотной селекции предлагаются специальные монохроматоры. Несмотря на высокую стоимость, эти устройства превосходно подходят для количественной микроскопии. К окончательному выбору источника освещения и спектрального диапазона для визуализации живых клеток необходимо подходить с учетом того факта, что высокоинтенсивный свет любого спектрального состава по своей природе вреден для живых клеток. Независимо от того, оптимизирован спектральный диапазон, или нет, источник света все время, за исключением непосредственно момента съемки, должен быть закрыт затвором.
Заключение
На этапе настройки конфигурации микроскопической оптической системы для визуализации живых клеток, важнейший аспект, зачастую, заключается в необходимости компромисса между поддержанием жизнеспособности клеток и достижением наилучшего временного и пространственного разрешения. Конструкции большинства коммерческих микроскопов разработаны с целью получения изображений максимального качества, но не обязательно для поддержания клеточных культур в здоровом состоянии. Тем не менее, при тщательном планировании, стандартный серийный микроскоп можно легко модифицировать в настоящую систему для визуализации живых клеток. Особое внимание следует уделить камерам для образцов, дрейфу фокусировки, цифровым фотокамерам, источникам освещения, затворам, комбинациям фильтров и компенсации вибраций. Описанные в настоящем обзоре концепции доказали свою практичность и эффективность в результате целого ряда исследований.






.png)