Благодаря растущему числу исследований, использующих методы визуализации живых клеток, и стремительным успехам в области технологии флуоресцентных белков и синтетических флуорофоров, складывается принципиальное понимание природы функционирования клеток и тканей. По существу, визуализация живых клеток стала не только необходимым инструментом в большинстве биологических лабораторий, занимающихся изучением клеток, но и стандартной методикой, применяющейся в различных областях нейробиологии, биологии развития, фармакологии и других биомедицинских дисциплинах.
Одной из наиболее существенных проблем при проведении экспериментов по визуализации живых клеток является поддержание на предметном столике микроскопа условий, благоприятных для нормального функционирования клеток и сохранения их в здоровом состоянии, в то время как они освещаются в присутствии синтетических флуорофоров и/или флуоресцентных белков.
Поддержание жизнеспособности клеток на предметном столике микроскопа
Одним из важнейших факторов успеха в экспериментах по получению изображений живых клеток является строгий контроль окружающей культуральной среды. Хотя, условия, в которых клетки содержатся не предметном столике микроскопа, зависят от организма и сильно отличаются по многим параметрам, именно эти условия часто определяют успех или неудачу эксперимента. В камере, в которой происходит выращивание и получение изображений клеток, довольно легко контролировать и регулировать некоторые физические параметры, например, температуру и атмосферные условия (состав и влажность газовой смеси), питательные добавки, буферизацию (pH) среды для выращивания и осмолярность культуральной среды.
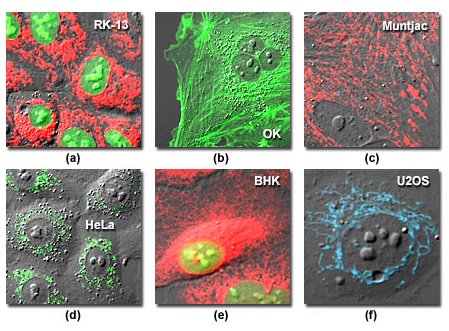
Рис. 1. Визуализация живых клеток при помощи флуоресцентных белков и ДИК
На рисунке 1 представлена серия изображений независимых клеточных линий, каждая из которых окрашена отдельной комбинацией синтетических флуорофоров и/или флуоресцентных белков. Показанные на рисунке 1(a) эпителиальные клетки почки кролика (линия RK-13) были трансфецированы гибридной плазмидой усовершенствованного желтого флуоресцентного белка (EYFP) и сигнальным ядерным пептидом, с целью локализации зеленовато-желтой метки внутри ядер. Затем, с целью окраски митохондрий, клетки были обработаны митохондриальным красителем MitoTracker Red CMXRos. На рисунке 1(b) представлены проксимальные цилиндрические эпителиальные клетки почки опоссума (линия OK), трансфецированные вектором внутриклеточной локализации EYFP-актина, с целью мечения филаментного актина цитоскелетной сети. На рисунке 1© представлены митохондрии клеток индийского мунтжака, трансфецированные фузионным вектором DsRed2, а на рисунке 1(d) показаны пероксисомы клеток цервикальной карциномы человека (линия HeLa), помеченные EGFP-пероксисомальной рекомбинантной (химерической) плазмидой. На рисунке 1(e) представлена адгезивная культура нормальных клеток фибробласта почки сирийского золотистого хомячка (линия BHK-21), трансфецированных смесью DsRed2 FP-эндоплазматической сети и векторами внутриклеточной локализации EGFP-ядер, и полученная в результате локализация ядерной зеленой флуоресцентной белковой метки и оранжево-красного зонда для эндоплазматической сети. И, наконец, на рисунке 1(f) представлены клетки костной остеосаркомы человека (линия U2OS), трансфецированные лазурным флуоресцентным белком, слитым с митохондриальной последовательностью-мишенью с целью подсвечивания митохондрий. Каждое, из представленных на рисунке 1, изображений регистрировалось в отдельном канале по методу дифференциально-интерференционного контраста и накладывалось на флуоресцентный канал (каналы) с целью определения границ клеток и иных общих структурных особенностей, например, ядер.
При разработке планов по наблюдению живых клеток и длительных экспериментов по получению изображений необходимо очень серьезно отнестись к ряду важных факторов. Для четкой визуализации интересующих исследователя биологических компонентов необходимо правильно окрасить образец соответствующим флуоресцентным белком или синтетическим флуорофором. Возможно, даже более важным аспектом является содержание клеточной культуры в условиях, способствующих ее росту и нормальному функционированию, с тем, чтобы исключить потенциальные искажения в интерпретации результатов эксперимента. Кроме того, методика визуализации клеток должна обеспечивать достаточное пространственное и временнóе разрешение, не вызывать фототоксичность и не влиять на локализацию флуоресцентных зондов. Среди наиболее важных стандартных аспектов визуализации живых клеток необходимо отметить температуру, насыщенность кислородом, влажность, осмолярность, pH (буферизацию среды), фототоксичность, лабораторные условия, дрейф фокусировки микроскопа, интенсивность флуоресцентного сигнала, проступание и разрешение (мы подробно рассмотрим эти параметры ниже; см. также таблицу 1).
Сохранение клеток на предметном столике микроскопа живыми и здоровыми является, несомненно, наиболее важным аспектом любого исследования с получением изображений живых клеток. Для этого, обычно, требуется сочетание изобретательности в сфере механики с глубоким пониманием биологии исследуемой клетки или ткани. Хотя многие лаборатории и стали экспертами в вопросе выращивания культивируемых клеток в диоксид-углеродных инкубаторах с регулируемой температурой, все же, задача сохранения клеток на предметном столике микроскопа на протяжении длительных экспериментов с получением изображений намного более сложна. Камера, в которой находятся исследуемые клетки (или ткани), на протяжении всего эксперимента должна обеспечивать их нормальное функционирование и неограниченный доступ для объектива микроскопа. Эта задача становится особенно трудновыполнимой в случае использования масляно или водо-иммерсионных объективов. Во многих случаях исследователь должен суметь в процессе получения изображений ввести реагент (с целью изменения хода определенного клеточного процесса), не нарушая последовательность съемки в заданном интервале времени смещением фокусировки или предметного столика микроскопа. Другими важными факторами являются простота, надежность и приемлемая стоимость эксперимента. Последующее обсуждение посвящено, главным образом, клеткам млекопитающих, однако, методики для других организмов отличаются несущественно и, как правило, менее строги. Например, культуры клеток дрожжей, насекомых и растений не предъявляют строгих требований к температуре, а клетки бактерий сравнительно нетребовательны к составу среды.
Культуральные среды для линий клеток млекопитающих
Хотя первые среды для клеточных и тканевых культур состояли из смесей эмбриональных экстрактов, сыворотки, гидросилатов белков и множества других жидкостей организма, очень скоро для культивирования стабильных клеточных линий потребовался переход к определенным средам, исходя из биохимических требований. Наиболее популярными из этих сред являются базальная (EBM) и минимальная поддерживающая (MEM) среда Игла, модифицированная по способу Дульбекко среда Игла (DMEM), среды Ham’s (F-10 и F-12), а также два состава культуральных сред высшей очистки (RPMI 1640 и RPMI 199), созданных в институте Roswell Park Memorial Institute. Кроме того, для культивирования клеток в отсутствие бикарбонатного буфера (и двуокиси углерода) широко используется среда Лейбовица (Leibovitz L-15). Все перечисленные культуральные среды требуют добавления сыворотки (полученной, как правило, из эмбрионов новорожденных телят или жеребят) в конечной объемной концентрации от 5 до 20 процентов. Кроме того, для культивирования узкоспециализированных клеток в строго определенных условиях были разработаны бессывороточные среды, оказавшиеся весьма полезными в биофармацевтической промышленности. Многие лаборатории, занимающиеся культивированием клеток самых разных видов, зачастую идут на компромисс, и вместо строго определенного состава используют смесь сложной среды, например, Ham’s F-12, со второй средой (например, DMEM), содержащую в больших концентрациях аминокислоты и витамины.
Составы клеточных культуральных сред весьма разнообразны, но большинство рецептур содержит аминокислоты, витамины, неорганические соли (минералы), следовые элементы, компоненты нуклеиновых кислот (основания и нуклеозиды), сахара, коферменты, липиды, интермедиаты цикла трикарбоновых кислот и целый ряд других биохимикатов. Простые среды, такие, как MEM, содержат только незаменимые аминокислоты, витамины и соли, тогда как в составы более сложных сред (RPMI и бессывороточных) входят сотни компонентов. Как правило, клеточные культуральные среды разрабатываются для конкретных целей, включая обычное выращивание нормальных и бессмертных (трансформированных) линий клеток, инициацию исходных культур, анализ распространения вирусов, изготовление фармацевтических препаратов и создание определенных условий выращивания для генетических версий. Среди прочих параметров, во всех тканевых культуральных средах контролируются pH, степень буферизации, концентрация кислорода, осмолярность, вязкость и поверхностное натяжение. Даже при кратковременном нахождении клеток под микроскопом, в системе визуализации живых клеток необходимо тщательно воспроизвести все указанные параметры среды.
Табл. 1 Параметры окружающей среды для линий клеток млекопитающих
|
Параметр
|
Оптимальный диапазон
|
Замечания
|
|
Температура
|
28-37°C
|
Контролируйте при помощи нагревателей камеры для образцов, используйте встроенные проточные нагреватели, обогреватели объектива,
устройства контроля внешних условий
|
|
Оксигенация
|
Изменяемая
|
Регулярно заливайте или меняйте среду
Используйте камеры большого объема
|
|
Влажность
|
97-100%
|
Закрытая (герметичная) камера
Кондиционируемая камера с искусственным климатом
Система автоматического заполнения для открытых камер
|
|
рН
|
7,0-7,7
|
Используйте буферную среду HEPES
Регулярно заливайте или меняйте среду
Не используйте феноловый красный индикатор
|
|
Осмолярность
|
260-320 mosM
|
Не допускайте испарения
Закрытая (герметичная) камера
Кондиционируемая камера с искусственным климатом
|
|
Атмосфера
|
Воздух или 5-7%
двуокиси углерода
|
Для воздушной закрытой (герметичной) камеры используйте буферную среду HEPES
Камера с контролируемой атмосферой
|
|
Буфер для среды
|
Бикарбонат или синтетические биологические буферы
|
Избегайте фототоксичности
Закрытые и открытые камеры
Камера с контролируемой атмосферой
|
Клетки большинства популярных линий, использующихся для визуализации, очень хорошо растут в диапазоне значений pH от 7,2 до 7,4. Однако, некоторые нормальные фибробласты лучше функционируют при несколько бóльших значениях pH (до 7,7), тогда как многие трансформированные клеточные линии быстрее растут в более кислых средах (вплоть до pH = 7,0). В случаях критичности pH для точности эксперимента, следует выполнить анализ эффективности выращивания при запланированном значении pH, чтобы проверить способность выбранной клеточной линии к нормальному функционированию. Для визуального определения приблизительного значения pH, в составы большинства имеющихся на рынке сред входит индикаторный краситель (обычно, феноловый красный). В растворе с pH = 7,4 феноловый красный создает ярко-красный цвет, который при pH = 7,0 сменяется оранжевым, а при pH = 6,5 — желтым. Изменение цвета часто можно наблюдать по мере того, как в процессе формирования культурами слившихся монослоев, среда становится более кислой. При pH = 7,6 феноловый красный дает розовый цвет, а при pH = 7,8 и выше — пурпурный. Многие лаборатории, занимающиеся культурами тканей, считают удобным для сравнения культуральных сред сформировать при помощи фенолового красного ряд стандартных значений pH в сбалансированном солевом растворе. Несмотря на то, что, благодаря высокому коэффициенту поглощения видимого света, индикаторный краситель и является очень важным средством для обычных клеточных культур, следует избегать его применения в экспериментах по получению флуоресцентных изображений живых клеток, чтобы снизить уровень фоновой засветки и предотвратить фототоксичность. В связи с этим, составы большинства популярных сред поставляются на рынок в виде стерильных жидкостей или порошков без фенолового красного.
Для регулирования уровня pH практически всем клеточным линиям требуется буферная система на основе двуокиси углерода и бикарбоната. Культивирование должно осуществляться в атмосфере с небольшим количеством двуокиси углерода (обычно, 5–7%, в зависимости от концентрации бикарбоната), в специальных инкубаторах, позволяющих строго контролировать концентрацию растворенного газа. Создание и поддержание атмосферы с требуемой концентрацией двуокиси углерода при получении изображений живых клеток может оказаться затруднительным. Как правило, для этого требуются культуральные камеры, специально предназначенные для регулирования атмосферы. Применение синтетических биологических буферов, например, TRIS и HEPES, представляются сомнительным средством исключения потребности в двуокиси углерода, поскольку многие клеточные линии не переносят недостатка углекислоты, особенно, при низких концентрациях клеток. В общем случае, для поддержания уровня pH в пределах физиологического диапазона (в отсутствие углекислотной атмосферы) достаточно от 10 до 20 миллимолей буфера HEPES, однако, для оптимального роста клеток культуральную среду необходимо пополнять бикарбонатом натрия.
Как правило, результатом попыток вырастить клетки под микроскопом с использованием только буфера HEPES является резкое снижение скорости роста (особенно, в долгосрочных экспериментах). Кроме того, необходимо тщательно изучить способность каждой клеточной линии расти и функционировать в среде, не содержащей буферную систему из двуокиси углерода. Следует отметить, что использование буфера HEPES в качестве бикарбонатной буферной системы для клеточных культуральных сред только снижает скорость дрейфа pH и не исключает прогрессирующего увеличения щелочности, происходящего при воздействии атмосферы на культуру. К тому же, многочисленные отчеты свидетельствуют о токсичности, проявляемой HEPES в ходе экспериментов по получению изображений живых клеток, которая обусловлена, вероятно, повышенной степенью формирования этим синтетическим буфером свободных радикалов в условиях необходимого для визуализации флуоресцентных зондов освещения. С целью исключения двуокиси углерода за счет использования пирувата натрия и буферизации высокими концентрациями аминокислот, разработана специальная среда Leibovitz L-15. Включение пирувата натрия в культуральную среду позволяет клеткам повысить эндогенную выработку двуокиси углерода, теоретически делая их независимыми от этого газа, (как и от бикарбоната). Однако, многие клеточные линии плохо адаптируются к среде L-15, в связи с чем, перед проведением экспериментов по получению изображений живых клеток на базе этой среды требуется выполнить несколько проверочных циклов.
Несмотря на то, что для большинства культур вполне пригодно атмосферное давление кислорода, в общем случае, для клеточных линий этот параметр может колебаться в очень широких пределах. Обычно, клеткам млекопитающих in vivo требуется кислород для дыхания, однако, при выращивании в сосудах для культивирования первичных клеточных линий или после иммортализации клеток, процесс дыхания зачастую успешно заменяется гликолизом (анаэробный процесс). На скорость проникновения (диффузии) кислорода к адгезивным клеткам, выращиваемым на стеклянной или пластмассовой поверхности, может влиять толщина слоя культуральной среды, которая должна поддерживаться на уровне менее 5 миллиметров. В большинстве случаев, для получения изображений живых клеток строгая регулировка концентрации кислорода не требуется. Напротив, в качестве стратегического средства снижения уровня возможных фотоповреждений в результате реакций со свободными радикалами кислорода во время флуоресцентного освещения, часто используется метод снижения содержания кислорода. Однако, следует отметить, что снижение давления кислорода также может оказаться губительным для клеток, если они начнут испытывать гипоксический стресс. Наиболее распространен метод снижения уровней кислорода с использованием коммерческих систем кислородного обеднения, например, системы Oxyrase. Альтернативная методика ограничения повреждений свободными радикалами кислорода состоит во введении в среду акцепторов радикалов, например, аскорбата (аскорбиновой кислоты; витамина C) или Trolox (производная витамина E). Тем не менее, в качестве альтернативы следует рассматривать также и методику снижения интенсивности освещения в сочетании с высокочувствительными фотокамерами.
Многие популярные клеточные линии обладают достаточно широким допуском по осмолярности и хорошо растут в диапазоне значений осмолярности от 260 до 320 миллиосмоляр (milliosmolar). В случае рутинного выращивания клеток в чашках Петри или культур на открытой среде, с целью компенсации испарения гипотоническая среда может заменяться. При добавлении органических буферов или препаратов для выбора плазмид, например HEPES и G-418, соответственно, важно контролировать осмолярность культуральной среды. Изначально концентрация ионов и органических нутриентов при получении изображений живых клеток задается выбранной для эксперимента средой. Однако, небольшие объемы сред, которые способно вместить большинство камер для визуализации, изменяются вследствие испарения (как правило, эта проблема усугубляется при нагревании среды до 37 градусов Цельсия). Поэтому, в процессе помещения клеток в камеры или при замене культуральной среды в случае испарения некоторого ее объема, необходимо принимать специальные меры предосторожности (клетки очень чувствительны к резким изменениям осмолярности). Кроме того, в процессе получения изображений следует минимизировать испарение за счет использования герметичной системы, либо, в случае использования открытой камеры, путем покрытия среды маслом, имеющим плотность, меньшую плотности воды (обычно, это минеральное масло), либо путем увлажнения камеры. Следует помнить, что, в общем случае, микросреда в небольшом объеме камеры для получения изображений живых клеток по своей природе менее стабильна, чем среда в диоксид-углеродном инкубаторе, и требует повышенного внимания ко всем деталям.
Выбор клеточных линий для получения изображений живых клеток
Выбор клеточных линий для получения изображений живых клеток часто определяется (и ограничивается) рядом факторов, включая целевые наблюдения исследования, способность клеток окрашиваться синтетическими флуорофорами, эффективность трансфекции, а также способность конкретной линии клеток переносить жесткие окружающие условия культуральной камеры и освещение. Очень часто клеточная линия, демонстрирующая превосходные свойства в одной или в нескольких из упомянутых категорий, в другой работает очень слабо, либо не функционирует полностью. Например, с целью исключительно точного выявления сложных деталей клеточной структуры, нормальные эндотелиальные клетки легочной артерии быка (линия BPAE) можно связывать и окрашивать синтетическими флуорофорами. Однако, эта линия допускает трансфекцию векторами флуоресцентного белка только с низкой эффективностью (менее 5 процентов) и сравнительно плохо переносит длительное освещение с низкими уровнями интенсивности, которое никак не влияет на многие другие клеточные линии. И наоборот, эпителиальные клетки почки кролика (линия RK-13) с высокой эффективностью трансфецируются различными плазмидами и очень устойчивы к высоким уровням освещения (включая лазерное излучение) в процессе повторяющихся на протяжении нескольких дней последовательностей получения изображений в течение заданного времени, но не окрашиваются в достаточной степени популярными флуорофорами (например, MitoTrackers), предназначенными для визуализации живых клеток.
Решающим фактором успешного наблюдения биологических процессов в живых клетках является наличие у выбранной для исследования и получения изображений клеточной линии необходимых морфологических и физиологических свойств, позволяющих определенно выявить интересующие исследователя аспекты. В исследованиях, направленных, например, на митоз, многие клеточные линии малопригодны для получения изображений, из-за того, что делящиеся клетки приобретают сферическую форму и могут отделяться от субстрата. Напротив, клетки, остающиеся в процессе митоза плоскими и соединенными с субстратом, превосходно подходят для выявления тончайших деталей митотического веретена во время деления клеток. Среди наиболее пригодных для исследований митоза клеточных линий отметим клетки почки кенгуровой крысы (линии PtK1 и PtK2; см. таблицу 2), которые, хотя и трансфецируются только с низкой эффективностью, однако, содержат небольшое количество хромосом, которые легче различать в микроскоп. Некоторые другие линии почечных клеток, в том числе одна от свиньи (LLC-PK1) и вторая — от африканской зеленой мартышки (BS-C-1), в процессе митоза также остаются прикрепленными к субстрату и намного более восприимчивы к трансфекции. Эти клетки (свиньи и мартышки) содержат больше хромосом, чем клетки кенгуровой крысы, но легче трансфецируются и дают изображения, что делает их превосходным альтернативным материалом для исследования митоза. Кроме пригодности для наблюдений митотического веретена, клетки, остающиеся плоскими на стекле культуральной камеры во время деления, могут выявлять распределение других клеточных компонентов, таких, как комплекс Гольджи, элементы цитоскелета, эндоплазматическая сеть и митохондрии.
Табл. 2 Пригодные для визуализации живых клеток клеточные линии млекопитающих
|
Клеточная линия
|
Тип клеток
(морфология)
|
Происхождение
(ткань)
|
Вид
|
Маркер
(области использования)
|
|
B-16
|
Веретенообразные
|
Меланома
|
Мышь
|
Вырабатывает меланин
Исследования цитоскелета
|
|
BHK-21
|
Фибробласты
|
Почка
|
Хомяк
|
Трансфекция плазмид
и вирусов
|
|
CHO-K1
|
Эпителиальные
|
Яичник
|
Хомяк
|
Требует пролина
Трансфекция ДНК
|
|
COS-7
|
Фибробласты
|
Почка
|
Мартышка
|
Т-антиген
Трансфекция ДНК
|
|
LLC-PK1
|
Эпителиальные
|
Почка
|
Свинья
|
Митоз
Трансфекция ДНК
|
|
HeLa
|
Эпителиальные
|
Шея
|
Человек
|
Цитокератин
Лизофосфатидилхолин
|
|
MDCK
|
Эпителиальные
|
Почка
|
Собака
|
Цитокератин
Купола, перенос
|
|
NIH-3T3
|
Фибробласты
|
Эмбрион
|
Мышь
|
Трансфекция
плазмид
|
|
PC-12
|
Составные
|
Надпочечник
|
Крыса
|
Реакция
фактора роста нервов
|
|
PtK2
|
Эпителиальные
|
Почка
|
Кенгуровая крыса
|
Цитокератин
Трансфекция ДНК
|
|
B-16
|
Веретенообразные
|
Меланома
|
Мышь
|
Вырабатывает меланин
Исследования цитоскелета
|
Исследования цитоскелета следует проводить на клетках, проявляющих высокие уровни экспрессии и с характерной локализацией исследуемого белка (белков). Как правило, нитевидные актиновые стрессорные волокна намного более четко определяются в клетках фибробласта, чем в эпителиальных клетках, однако, из этого правила существует множество исключений. В цитоплазме эпителиальных клеток некоторых линий, (хотя, и не повсеместно), промежуточные филаменты цитокератина образуют разветвленные сети, которые легко визуализируются за счет иммунофлюоресценции или флуоресцентных белков. К сожалению, в клетках фибробласта, как и во многих типах эпителиальных и эндотелиальных клеток, цитокератиновые сети либо плохо определяются, либо практических отсутствуют. Аналогично, виметин, дезмин, периферин, нейрофиламенты, ламины и промежуточные филаменты глиального фибриллярного кислого белка (GFAP) образуют заметные структурные сети в клетках одних типов, и трудно обнаруживаются в других. Практически во всех случаях, прежде чем пытаться локализовать флуоресцентные белки для получения изображений живых клеток, необходимо зафиксировать и протестировать линию клеток-мишеней путем маркировки синтетическими флуорофорами и/или антителами.
Использование флуоресцентных белков для визуализации живых клеток (в самых различных приложениях) открыло новые методы получения информации, касающейся динамических процессов в клеточной биологии. Современные методы флуоресцентной микроскопии, основанные на восстановлении после фотообесцвечивания (FRAP), резонансном переносе энергии (FRET), а также корреляционная спектроскопия (FCS) и спекл-микроскопия (FSM) в значительной степени способствовали использованию флуоресцентных белков. Эти вездесущие молекулы также были генетически модифицированы, с целью получения нового поколения фотоактивируемых оптических индикаторов, позволяющих метить отдельные специфические члены большой молекулярной популяции. В результате соединения методики Форстера по резонансному переносу энергии с технологией флуоресцентных белков получен новый класс физиологических биосенсорных зондов, пригодных для анализа различных ионов: кальция, натрия, калия, хлорида и pH, вдобавок к множеству клеточных явлений, включая ферментативную активность, изменения потенциала мембраны, высвобождение нейротрансмиттеров и окисление-восстановление. Все перечисленные новые методики базируются на получении изображений живых клеток, экспрессирующих генетически кодированные флуоресцентные зонды.
В таблице 2 представлен перечень некоторых линий клеток млекопитающих, использовавшихся во многих экспериментах по получению изображений живых клеток, описанных в научной литературе. Огромное количество информации было получено при исследовании хорошо изученной иммортализированной линии эпителиальных клеток (HeLa) цервикальной карциномы человека. Эту сильную клеточную линию можно эффективно трансфецировать большинством векторов флуоресцентных белков, и получать высокие уровни экспрессии и определенную локализацию. Трансформированные клетки почки африканской зеленой мартышки (линия COS-7) использовались для открытия динамики белка в комплексе Гольджи и эндоплазматической сети, тогда как линии клеток хомяка (BHK-21 и CHO-K1) являются фаворитами в исследованиях молекулярной и клеточной биологии вирусов, внутриклеточной ферментативной активности, рецепторов, промоторных функций и механизмов транспортировки. Другие клеточные линии из таблицы 2 также восприимчивы к трансфекции, микроинъекциям и маркировке синтетическими флуорофорами в длительных экспериментах по получению изображений с помощью широкопольной и конфокальной флуоресцентной микроскопии.
Краткий обзор камер для визуализации изображений живых клеток
Камеры для образцов — это неотъемлемая часть истории микроскопии. На протяжении многих лет в публикациях описываются многочисленные конструкции, обладающие превосходными оптическими характеристиками и, в то же время, позволяющие сохранять образцы в течение различных промежутков времени. Краткосрочные (20–30 минут и менее) эксперименты с получением изображений можно проводить путем простого помещения покровного стекла, содержащего адгезивные клетки, на предметное стекло микроскопа с использованием разделителей, предотвращающих повреждение клеток (в клетках некоторых линий физический стресс может вызвать автофлуоресценцию). Для обеспечения водонепроницаемости и предотвращения испарения культуральной среды, покровное стекло можно закрепить любым из многочисленных герметиков, включая расплавленную агарозу, резиновый клей, вакуумную смазку или удобный препарат под названием VALAP (смесь 1:1:1 вазелина, ланолина и парафина). В качестве разделителей, предотвращающих непосредственный контакт клеток с предметным стеклом микроскопа, можно использовать прокладку из силиконового каучука (имеются на рынке), либо кусочки битого покровного стекла. Покровное стекло устанавливается на разделительную прокладку (прокладки) стороной с клетками вниз. Промежуток между покровным и предметным стеклами заполняется физиологическим буфером (например, физиологический раствор с фосфатным буфером, PBS). Края покровного стекла герметизируются предпочтительным реагентом, и предметное стекло помещается на предметный столик микроскопа для получения изображений. Без среды для выращивания и контроля температуры клетки могут нормально функционировать в течение всего лишь нескольких минут, однако, зачастую, этого времени достаточно для получения требуемых изображений.
Возможность наблюдения и получения изображений живых клеток на предметном столике микроскопа, а также содержание культуры в близких к оптимальным условиях, при проведении более длительных экспериментов обеспечивается специальными камерами с искусственным климатом. Как правило, камера для получения изображений оснащается стеклянным окном, толщиной, обычно, равной толщине покровного стекла (около 170 микрометров), которое позволяет без помех наблюдать клетки при помощи объективов, с большой числовой апертурой. Контроль температуры (критического параметра для большинства клеток), часто реализуется за счет использования периферийных источников инфракрасного излучения или нагретого воздуха (например, фена или нагревателя для яиц), металлической нагревательной пластины с термисторным управлением, подсоединенной непосредственно к камере, либо тонких оптически прозрачных покрытий из оксидов металлов, которые термически напыляются на поверхность покровного стекла, что обеспечивает более эффективную передачу тепла к камере.
Все многообразие имеющихся на рынке (либо изготавливаемых собственными силами) камер для получения изображений живых клеток делится на две основные функциональные категории: открытые камеры, аналогичные чашкам Петри, со свободным доступом к атмосфере; и закрытые камеры, которые герметизируются для защиты клеток от испарения культуральной среды. Камера открытого типа, как правило, обеспечивает быстрый доступ к выращиваемым клеткам, что позволяет выполнять микроинъекции, добавлять препараты, менять культуральную среду и выполнять другие манипуляции с клетками. И, напротив, закрытые камеры обеспечивают лучшую изоляцию от внешней среды, но затрудняют доступ к клеткам. Большинство закрытых камер оборудуется портами для пополнения свежей культуральной средой и препаратами в ходе эксперимента, что позволяет не прерывать последовательность получения изображений. В таких системах перфузия регулируется перистальтическим насосом, либо опрыскивателем с приводом от двигателя, либо при помощи гравитационного манифольда. В случае добавления в закрытую камеру свежих растворов очень важно предварительно уравнять их температуру с температурой клеток. Более того, многие клетки чувствительны к сдвигу, поэтому, перфузию адгезивных клеток, соединенных с покровным стеклом необходимо выполнять с очень малыми скоростями. Некоторые, наиболее современные камеры закрытого типа оснащаются системами контроля усилия сдвига.
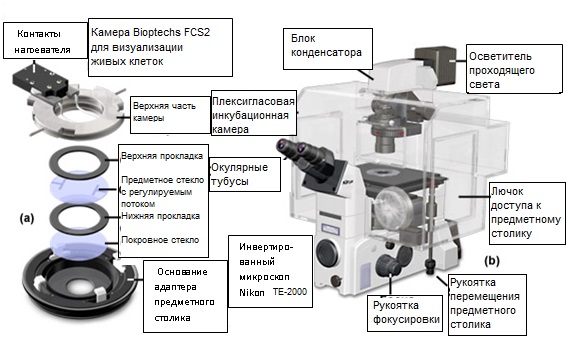
Рис. 2. Камера для визуализации живых клеток и инкубатор с контролируемой окружающей средой для микроскопа
В большинстве случаев, имеющиеся на рынке простейшие открытые камеры для получения изображений представляют собой обыкновенный сосуд для культивирования тканей или чашку Петри, с установленным на днище покровным стеклом. Предлагаются стандартные (диаметром 35 мм и 60 мм) стерильные чашки Петри, в которых просверлено небольшое отверстие (диаметром около одного сантиметра), а в пластмассу вплавлено покровное стекло толщиной 170 мкм, через которое можно получать изображения с высоким разрешением. Кроме того, на рынке имеются прямоугольные покровные стекла, а также предметные стекла с герметично прикрепленной пластмассовой камерой для получения изображений. В камере имеется одно или несколько углублений. Однако, такие камеры достаточно дороги. Обе упомянутые конструкции сравнительно просты в использовании, но не герметичны. Поэтому, в ходе эксперимента культуральная среда испаряется, в связи с чем, необходимо внимательно следить за ее уровнем. И, наконец, в большинстве простых камер для получения изображений нет никаких систем обогрева. Поэтому, при использовании таких камер, предметный столик микроскопа должен быть оборудован вспомогательной системой обогрева, способной вместить камеру с образцом. Без контроля температуры эффективность открытой камеры лишь немного выше, чем у описанной ранее системы, состоящей из уплотненных герметиком предметного и покровного стекол.
Герметичные закрытые камеры для получения изображений, подобные представленной на рисунке 2(a) камере Bioptechs FCS2, дороже большинства простых камер открытого типа, однако, предоставляют гораздо больше возможностей для контроля над окружающей средой, и позволяют сохранять клетки здоровыми в течение многих часов (и даже дней и недель). В типовой камере закрытого типа имеются две оптически правильные поверхности, разделенные перфузионным кольцом с уплотнительными прокладками. Эта многослойная конструкция зажимается в металлическом или композитном корпусе, обеспечивающем контроль температуры и адаптацию к предметному столику микроскопа. Такая камера для получения изображений, в сравнении с камерами открытого типа, обеспечивает достаточно высокую степень регулировки скорости перфузии, объема среды, температуры, атмосферы, геометрии потока и оптической стабильности. Современная закрытая камера (рисунок 2(a)) сокращает затраты времени на замену жидкости, обеспечивает регулирование потока перфузионной среды, (позволяя, тем самым, избежать сдвига адгезивных клеток), высокоточную регулировку температуры и непосредственную близость оптических поверхностей, что дает возможность использовать для наблюдений объективы (микроскопов) с высокой числовой апертурой. Кроме того, пользователь имеет возможность задавать параметры потока культуральной среды на поверхности клеток в соответствии с требованиями эксперимента. Сегодня на рынке представлен широчайший спектр закрытых камер для получения изображений живых клеток.
Конструкция камеры для получения изображений позволяет эффективно объединять инкубатор с клеточной культурой и инвертированный микроскоп, обеспечивая практически полный контроль над окружающей средой (см. пример на рисунке 2(b)). Кожух инкубатора изготавливается, как правило, из органического стекла и окружает предметный столик микроскопа, объективы, флуоресцентные фильтры и конденсор проходящего света. Такие камеры можно использовать с самыми различными сосудами для культивирования, включая стандартные культуральные сосуды, чашки Петри, предметные стекла микроскопов с установленными на них покровными стеклами, а также множество других, из уже упоминавшихся, открытых и закрытых систем. Температура поддерживается при помощи внешнего обогревателя (обычно, с принудительной подачей воздуха), а концентрация двуокиси углерода контролируется датчиком, соединенным с регулятором, через который подается чистый газ из баллона. Кроме того, такие камеры можно оснащать устройствами регулирования влажности, а в некоторых конструкциях предусмотрена система доступа исследователя в виде резиновых перчаток, что дает возможность выполнять операции с образцами (клетками) в процессе получения изображений, не нарушая равновесного состояния среды в камере. Для достижения высокой точности в поддержании температуры, некоторые из наиболее изощренных инкубаторных камер вмещают в себя практически весь микроскоп, за исключением окуляров, фотокамеры и осветителей. С другой стороны, камеры с искусственным климатом могут препятствовать быстрому доступу к образцу, и утомлять в случае необходимости периодически манипулировать образцом. Кроме того, высокая влажность внутри камеры способствует ускоренному разрушению смазки редукторов, а также окислению металлических поверхностей и покрытий линз, что повышает эксплуатационные затраты. Многие производители часто предлагают для своих инвертированных микроскопов инкубаторы специальной конструкции, а поставщики вторичного рынка заполняют ниши, как более простыми, так и более сложными моделями, наряду с несметным количеством полезных принадлежностей.
Как уже упоминалось, на рынке представлен широчайший спектр открытых и закрытых камер для получения изображений живых клеток. Многие из этих камер предназначены для достаточно узких применений. Прежде, чем ступить на нелегкий путь получения изображений живых клеток, целесообразно изучить различные варианты предлагаемых камер. Многие исследователи отдают предпочтение тем методикам, которые позволяют максимально использовать их опыт с помощью конкретных систем, и эти предпочтения охватывают определенный диапазон конструкций камер. Более того, имеются сообщения о камерах, сконструированных из обыкновенной изоляционной обшивки для ремонта жилья, клейкой ленты для герметизации воздуховодов и дешевых увлажнителей, подсоединенных к камере при помощи вытяжных труб от сушилок для белья. Ключевое требование состоит в том, что в любом эксперименте камера должна обеспечивать оптимальную для функционирования клеток окружающую среду, и иметь прозрачное оптическое окно для регистрации происходящих в камере явлений. Поскольку от эксперимента к эксперименту исследуемые переменные отличаются друг от друга, конструктивные предпочтения могут изменяться. Поэтому, наилучший подход состоит в опробовании различных систем, с целью определения наиболее подходящей для конкретной клеточной линии и условий эксперимента.






.png)