Введение во флуоресцентные белки
Открытие в начале 1960-х зелёного флуоресцентного белка провозгласило новую эру в клеточной биологии, поскольку позволило исследователям применять методы молекулярного клонирования, присоединяя флуророфорный компонент к многочисленным белкам и энзимам, чтобы наблюдать с помощью оптических микроскопов процессы в живых клетках. В сочетании с последними техническими достижениями широкопольной флуоресцентной и конфокальной микроскопии, включая быстродействующие цифровые камеры, работающие в условиях низкой освещённости, и лазерные системы с многоканальным слежением, зелёный флуоресцентный белок и его смещённые по цвету генетические дериваты оказались настолько эффективными в многочисленных экспериментах по наблюдению живых клеток, что их значение трудно переоценить.
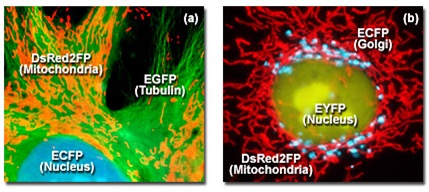
Рис. 1. Мультиокрашивание живых клеток флуоресцентными белками
Работая во Фрайдей Харбор Лабораториз (Friday Harbor Laboratories) университета Вашингтона, Осаму Шимомура (Osamu Shimomura) и Фрэнк Джонсон (Frank Johnson) выделили в 1961 году кальций-зависимый биолюминесцентный белок медузы Aequorea victoria, назанный ими экварином (aequorin). Во время процедуры выделения наблюдался второй белок, который не имел синего биолюминесцентного свечения экварина, но при облучении ультрафиолетом флуоресцировал зелёным. Благодаря этому свойству белок был неофициально назван зелёным флуоресцентным белком (GFP). В течение двух последующих десятилетий было установлено, что экварин и зелёный флуоресцентный белок функционируют вместе в органах свечения медуз, преобразовывая индуцируемые кальцием люминесцентные сигналы в зелёную флуоресценцию, характерную для этого вида.
Хотя ген для зелёного флуоресцентного белка был впервые клонирован в 1992 году, его потенциал, как молекулярного зонда, оценили лишь несколько лет спустя, когда продукты слияния стали применяться для генной экспрессии в бактериях и нематодах. С тех пор зелёный флуоресцентный белок стал синтезироваться для производства огромного количества различных окрашенных мутантов, гибридных белков и биосенсоров, обобщённо называемых флуоресцентными белками. Позже флуоресцентные белки были выделены и из других видов, что способствовало дальнейшему расширению цветовой палитры. С развитием технологии флуоресцентных белков значение этого генетически кодированного флуророфора для широкого круга приложений, помимо простого наблюдения меченных биомолекул в живых клетках, в полной мере стало осознаваться только сейчас.
На рисунке 1 приведены два примера мультиокрашивания живых клеток флуоресцентными белками, где слияние происходит на субклеточном уровне (на уровне органелл). Эпителиальная клетка кортикального проксимального канальца почки опоссума (ОК линия), представленная на рисунке 1(а), была трансфектирована набором флуоресцентных белков, соединённых с пептидными сигналами, осуществляющими опосредованный перенос белков либо к ядрам (усиленный (т. е. с усиленным свечением) голубой флуоресцентный белок, ECFP), либо к митохондриям (флуоресцентный белок DsRed: DsRed2FP), либо к сети микроканальцев (усиленный зелёный флуоресцентный белок, EGFP). Аналогичный образец, состоящий из клеток цервикальной аденокарциномы человека (HeLa линия), представлен на рисунке 1(b). Клетки HeLa были трансфектированы векторами, несущими кодирующие последовательности усиленного голубого и жёлтого (EYFP) флуоресцентных белков для соединеня с комплексом Гольджи и ядром, соответственно, а также вариант флуоресцентного белка морской анемоны Discosoma striata, DsRed2FP, нацеленный на митохондриальную сеть.
Зелёный флуоресцентный белок и его мутировавшие аллельные формы (синий, голубой и жёлтый флуоресцентный белок) используются для создания флуоресцентных химерных белков, которые, после трансфекции созданными векторами, могут быть экспрессированы в живых клетках, тканях и целых организмах. Красные флуоресцентные белки, выделенные из других видов, включая организмы коралловых рифов, имеют такую же ценность. Методика с применением флуоресцентных белков свободна от таких проблем, как очистка, мечение и введение меченых белков в клетки, а также от разработки специальных антигенов для поверхностных и внутренних антител.
Свойства и модификации зелёного флуоресцентного белка медузы Aequorea victoria
Существенным аспектом в свечении зелёного флуоресцентного белка является тот факт, что для развития и поддержания флуоресценции необходима целая нативная пептидная структура весом в 27 килодальтонов. Примечательно, что сам флуророфор образуется из триплета соседних аминокислот: остатков серина, тирозина и глицина в позициях 65, 66 и 67 (обозначаемых Сер-65 (Ser65), Тир-66 (Tyr66) и Гли-67 (Gly67), см. рисунок 2) Хотя этот несложный аминокислотный рисунок широко распространён в природе, он не всегда вызывает флуоресценцию. Уникальность флуоресцентного белка заключается в том, что пептидный триплет находится в центре удивительно стабильной бочкообразной структуры, состоящей из 11 бета-слоёв, свёрнутых в цилиндр.
В гидрофобном окружении в центре зелёного флуоресцентного белка происходит реакция между карбоксильным углеродом в Сер-65 и азотом аминогруппы в Гли-67, которая приводит к образованию имидазолин-5-онового гетероциклического азотного кольца (как показано на рисунке 2). Дальнейшее окисление ведёт к объединению имидазолинового кольца с Тир-66 и созреванию флуоресцентного вида. Важно отметить, что нативный флуророфор зелёного флуоресцентного белка существует в двух состояниях. Преобладающая протонированная форма имеет максимум возбуждения на 395 нанометрах, а менее распространенная непротонированная форма поглощает приблизительно на 475 нанометрах. Тем не менее, независимо от длины волны возбуждения пик флуоресцентного свечения, хотя размытый и широкий, приходится на 507 нанометров.
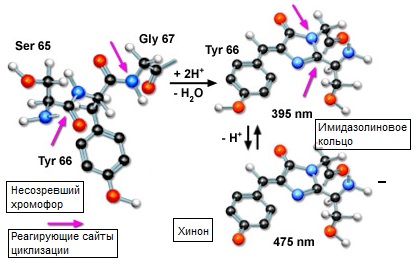
Рис. 2. Образование имидазолин-5-онового гетероциклического азотного кольца
Два основных свойства флуророфора флуоресцентного белка являются определяющими для его применения в качестве зонда. Первое — это сложность фотофизических свойств зелёного флуоресцентного белка, обеспечивающая существование значительного числа модификаций этой молекулы. Многие исследования были сосредоточены на тонкой настройке флуоресценции нативного зелёного флуоресцентного белка для получения многочисленных молекулярных красителей, но трудно переоценить применение этого белка в качестве исходного материала для создания новых флуорофоров с улучшенными свойствами, что, конечно, имеет огромное значение и потенциал. Второе свойство — сильная зависимость флуоресценции зелёного флуоресцентного белка от молекулярной структуры, окружающей трипептидный флуророфор.
Денатурация зелёного флуоресцентного белка разрушает флуоресценцию, что вполне предсказуемо, а мутации остатков, окружающих трипептидный флуорофор, могут значительно изменить его флуоресцентные свойства. Удивительная стабильность бета-бочонка, в котором находятся аминокислотные остатки, приводит к очень высокому квантовому выходу флуоресценции (до 80 процентов). Эта очень плотная белковая структура обеспечивает неизменность флуоресцентных свойств даже при изменениях pH, температуры и в присутствии денатурирующих агентов, таких как мочевина. Но при мутациях зелёного флуоресцентного белка эта стабильность обычно падает, что сказывается на флуоресценции, приводя к уменьшению квантового выхода и большей зависимости от окружающих условий. Хотя в некоторой степени это преодолевается дополнительными мутациями, дериваты флуоресцентных белков обычно более чувствительны к окружающим условиям, чем нативные виды. Эти изменения должны приниматься во внимание при организации экспериментов с генетическими вариантами.
Чтобы приспособить флуоресцентные белки к наблюдению различных систем млекопитающих, были произведены некоторые модификации исходного зелёного флуоресцентного белка, которые сегодня встречаются в большинстве применяемых вариантов. Первым шагом была оптимизация созревания белка для флуоресценции при температуре 37 градусов по Цельсию. Созревание флуророфора исходного типа вполне эффективно при 28 градусах, но увеличение температуры до 37 градусов приводит к существенному ухудшению созревания и уменьшению флуоресценции. Мутация остатка фенилаланина в позиции 64 (Фен-64 (Phe64)) в лейцин улучшает созревание белка для флуоресценции при 37 градусах, которая, по меньшей мере, не хуже наблюдаемой при 28 градусах. Эта мутация присутствует в большинстве применяемых вариантов флуоресцентных белков, полученных из Aequorea victoria, но это, как выяснилось при открытии других вариантов, не единственная мутация, улучшающая укладку при 37 градусах.
Улучшение созревания при 37 градусах было дополнено оптимизацией использования кодона для экспрессии в клетках млекопитающих, что тоже повысило яркость зелёного флуоресцентного белка, экспрессированного в этих клетках. В общей сложности, для усиления экспрессии в тканях человека в кодирующую последовательность было введено более 190 молчащих мутаций. Вставкой валина в качестве второй аминокислоты был введён участок инициации трансляции Козака (содержащий нуклеотидную последовательность A/GCCAT). Наряду с другими, обсуждаемыми ниже, эти усовершенствования привели к созданию очень эффективных красителей для наблюдения живых клеток млекопитающих и являются общими для всех применяемых сегодня флуоресцентных зондов, полученных из исходного белка медузы.
Цветовая палитра флуоресцентных белков
Спектральные кривые флуоресцентного свечения многочисленных генетических вариантов флуоресцентных белков, которые удалось получить, перекрывают практически весь видимый диапазон (см. таблицу 1). Усилия по мутагенезу исходного зелёного флуоресцентного белка медузы Aequorea victoria привели к созданию флуоресцентных красителей в цветовой гамме от синего до жёлтого и к тому, что они стали самыми распространёнными в биологических исследованиях репортерными группами in vivo. Флуоресцентные белки бо?льших длин волн, светящиеся в оранжевом и красном диапазонах, были получены из морской анемоны, Discosoma striata, и рифовых кораллов, принадлежащих к классу Anthozoa (коралловых полипов). И, тем не менее, разработка аналогичных белков с голубым, зелёным, жёлтым, оранжевым и тёмно-красным флуоресцентным свечением не прекращается. Сейчас разработки ведутся в направлении повышения яркости и стабильности флуоресцентных белков, что, в итоге, способствует повышению их эффективности.
Зелёные флуоресцентные белки
Хотя исходный зелёный флуоресцентный белок флуоресцирует достаточно интенсивно и чрезвычайно стабилен, его максимум возбуждения лежит близко к ультрафиолету. Поскольку ультрафиолетовый свет требует специальных оптических условий и способен нанести вред живым клеткам, он часто бывает непригоден для наблюдения живых клеток в оптической микроскопии. К счастью, максимум возбуждения зелёного флуоресцентного белка можно сдвинуть к 488 нанометрам (в голубой диапазон) с помощью точечной мутации, заменяющей серин в позиции 65 на остаток треонина (S65T). Эта мутация присутствует в большинстве распространённых вариантов зелёного флуоресцентного белка, называемых усиленным GFP (EGFP), которые выпускаются серийно в широком диапазоне векторов, предлагаемых БД Биосайенсис Клонтек (BD Biosciences Clontech), одним из лидеров по производству флуоресцентных белков. Более того, усиленная версия может наблюдаться с помощью общедоступных наборов фильтров, разработанных для флюоресцеина, и является одной из наиболее ярких из доступных сегодня флуоресцентных белков. Благодаря этим свойствам усиленный зелёный флуоресцентный белок стал одним из наиболее распространённых красителей и не имеет себе равных в экспериментах с одной меткой. Единственным недостатком EGFP является слегка повышенная чувствительность к pH и некоторая тенденция к димеризации.
Помимо усиленного зелёного флуоресцентного белка при наблюдении живых клеток сегодня применяются и другие варианты. Одним из лучших с точки зрения фотостабильности и яркости, может быть, является белок Эмеральд (Emerald), но применение этого варианта ограничено тем, что он не выпускается серийно. Некоторые производители предлагают гуманизированные варианты зелёного флуоресцентного белка, которые имеют определённые преимущества в экспериментах по резонансному переносу энергии флуоресценции (FRET). В результате замены фенилаланинового остатка в позиции 64 на лейцин (F64L; GFP2) получается мутант, который сохраняет пик возбуждения на 400 нанометрах и является эффективным партнёром усиленному жёлтому флуоресцентному белку. Вариант с мутацией S65C (обычная замена цистеина на серин), имеющий пик возбуждения на 474 нанометрах, стал выпускаться серийно в качестве более эффективного FRET партнёра для усиленного синего флуоресцентного белка, чем усиленный зелёный вариант с красным смещением. Наконец, белок рифового коралла, называемый ZsGreen1 (ZsЗелёный1), с эмиссионным пиком на 505 нанометрах был разработан в качестве замены усиленному зелёному флуоресцентному белку. При экспрессировании в клетках млекопитающих свечение белка ZsЗелёный1 гораздо ярче EGFP, но он имеет ограниченное применение в получении слитых мутантов и, подобно остальным белкам рифовых кораллов, склонен к формированию тетрамеров.
Жёлтые флуоресцентные белки
Семейство жёлтых флуоресцентных белков было запущено после того, как обнаружилось, что в структуре зелёного флуоресцентного белка треониновый остаток 203 (Thr203) находится рядом с хромофором. Замена этого остатка на тирозин была введена для стабилизации дипольного момента возбуждённого состояния хромофора и привела к 20-нанометровому сдвигу в сторону длинных волн как спектра возбуждения, так и эмиссионного спектра. Дальнейшие усовершенствования привели к разработке усиленного жёлтого флуоресцентного белка (EYFP), который является одним из наиболее ярких и распространённых среди флуоресцентных белков. Благодаря своей яркости в сочетании со спектром свечения усиленный жёлтый флуоресцентный белок является превосходным кандидатом на применение в экспериментах по мультиокрашиванию во флуоресцентной микроскопии. Будучи спаренным с усиленным голубым флуоресцентным белком (ECFP) или GFP2, усиленный жёлтый флуоресцентный белок также показал свою эффективность в экспериментах по переносу энергии. Однако, жёлтый флуоресцентный белок слишком чувствителен к кислым средам и теряет приблизительно половину своего свечения при pH 6,5. К тому же, EYFP оказался чувствителен к ионам хлорида и фотообесцвечивается гораздо быстрее зелёных флуоресцентных белков.
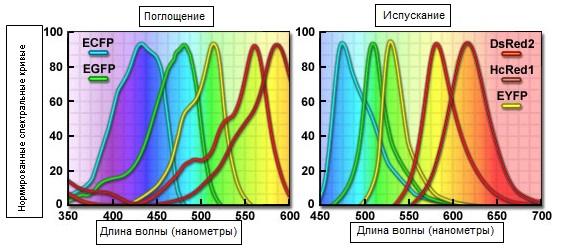
Рис. 3. Спектральные кривые распространённых флуоресцентных белков
Дальнейшее усовершенствование архитектуры флуоресцентных белков для жёлтого свечения привело к решению некоторых проблем жёлтых красителей. Цитрин (Citrine), вариант жёлтого флуоресцентного белка, получился гораздо ярче EYFP и значительно устойчивее к фотообесцвечиванию, кислой среде и другим внешним воздействиям. Другой дериват с названием Венера (Venus) имеет самое быстрое созревание и на сегодня является одним из самых ярких вариантов жёлтого белка. Белок рифового коралла ZsYellow1 (ZsЖёлтый1), первоначально клонированный из Zoanthus, обитающих в Индийском и Тихом океанах, производит реалистичное жёлтое свечение и идеален для мультиокрашенных приложений. Подобно белку ZsЗелёный1, этот дериват не столь эффективен для образования соединений, как EYFP, и склонен к формированию тетрамеров. Многие из более стабильных вариантов жёлтого флуоресцентного белка оказались полезными для количественной оценки результатов FRET исследований и могут быть полезными и в других приложениях
На рисунке 3 представлены спектральные профили поглощения и испускания для многих часто встречаемых и серийно выпускаемых флуоресцентных белков, охватывающие диапазон от голубого до дальнего красного. Варианты, полученные из медузы Aequorea victoria, включая усиленные голубой, зелёный и жёлтый флуоресцентные белки, демонстрируют пик свечения на длинах от 425 до 525 нанометрах. Флуоресцентные белки, полученные из рифовых кораллов, DsRed2 (DsКрасный2) и HcRed1 (HcКрасный1) (обсуждаются ниже), испускают на более длинных волнах, но подвержены олигомеризационным артефактам в клетках млекопитающих.
Синие и голубые флуоресцентные белки
Синий и голубой варианты зелёного флуоресцентного белка получаются прямой модификацией тирозинового остатка в позиции 66 (Тир-66) в исходном флуророфоре (см. рисунок 2). Конверсия этой аминокислоты в гистидин приводит к синему свечению с максимумом на 450 нанометрах, а конверсия в триптамин — к основному пику флуоресценции на 480 нанометрах с плечом на длине около 500 нанометров. Оба красителя флуоресцируют весьма слабо, и для повышения эффективности укладки и общей яркости требуются вторичные мутации. Но даже с этими модификациями усиленные версии этого класса флуоресцентных белков (EBFP и ECFP) флуоресцируют лишь с 25-40-процентной яркостью в сравнении с усиленным зелёным флуоресцентным белком. К тому же, возбуждение синего и голубого флуоресцентного белка наиболее эффективно в нечасто используемом спектральном диапазоне, поэтому для них требуются специальные наборы фильтров и лазерные излучатели.
Несмотря на недостатки синего и голубого флуоресцентного белка широкий интерес к экспериментам по мультиокрашиванию и FRET привёл к росту их применения во многих приложениях. Это особенно касается усиленного голубого флуоресцентного белка, который может быть возбуждён вне своего пика аргоновым ионным лазером (на спектральной линии 457 нанометров) и гораздо более устойчив к фотообесцвечиванию, чем синий дериват. В отличие от других флуоресцентных белков, среди исследователей не было особенного интереса к созданию лучших красителей в синем диапазоне, и главные их усилия были направлены на разработку усовершенствованных голубых вариантов.
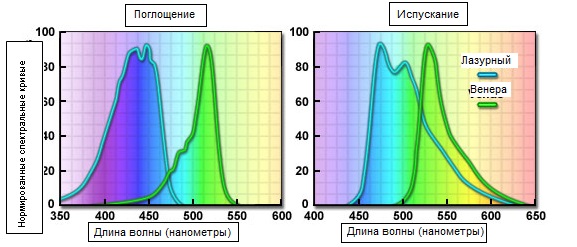
Рис. 4. Спектральные кривые спаренных для FRET флуоресцентных белков
Среди усовершенствованных голубых флуоресцентных белков AmCyan1 (AmГолубой1) и усиленный голубой вариант, называемый Cerulean (Лазурный) оказались наиболее перспективными. Полученный из рифового коралла, Anemonia majano, вариант флуоресцентного белка AmГолубой1 был оптимизирован кодонами человека для достижения относительно высокого уровня яркости и стойкости к фотообесцвечиванию при экспрессии в клетках млекопитающих по сравнению с усиленным голубым флуоресцентным белком. Но с другой стороны, этот краситель, подобно другим белкам рифовых кораллов, имеет тенденцию к образованию тетрамеров. Флуоресцентный краситель Лазурный был получен сайт-направленным мутагенезом усиленного голубого флуоресцентного белка для достижения более высокого коэффициента поглощения и квантового выхода. Лазурный минимум в 2 раза ярче усиленного голубого флуоресцентного белка и в экспериментах по FRET, в сочетании с жёлтыми флуоресцентными белками, например Венерой (см. рисунок 4), демонстрирует значительный рост отношения сигнал-шум.
Красные флуоресцентные белки
Главным направлением развития флуоресцентных белков стало создание такого красного деривата, которые бы не уступали или даже превосходили усиленные зелёные флуоресцентные белки по их полезным свойствам. Преимуществом красных флуоресцентных белков является их потенциальная совместимость с существующими конфокальными и широкопольными микроскопами (и их фильтрационными наборами), а также высокая эффективность при наблюдении целых животных, которые значительно прозрачнее для красного света. Поскольку создание мутантов из зелёного флуоресцентного белка медузы Aequorea victoria не увенчалось успехом за пределами жёлтого диапазона, внимание исследователей было обращено к тропическим рифовым кораллам.
Первый широко применяемый коралловый флуоресцентный белок был получен из Discosoma striata (Дискосомы полосатой) и обозначается DsRed (DsКрасный). Полностью созревший DsКрасный имеет максимум флуоресценции на 583 нанометрах и два пика в спектре возбуждения: основной на 558 нанометрах и другой, ниже, на 500 нанометрах. Тем не менее, использование DsКрасного сопряжено с некоторыми проблемами. Созревание флуоресценции DsКрасного происходит медленно и проходит через стадию зелёного флуоресцентного свечения. Называемый зелёным состоянием, этот артефакт оказался весьма проблематичным в экспериментах по мультиокрашиванию с применением других зелёных флуоресцентных белков из-за возникающего спектрального перекрытия. Более того, DsКрасный является тетрамером и может образовывать в живых клетках большие белковые соединения. И хотя эти свойства несущественны при использовании DsКрасного в качестве репортерной группы экспрессии генов, его эффективность как метки антигенной детерминанты крайне ограничена. В отличии от флуоресцентных белков медузы, с помощью которых были помечены сотни белков, DsКрасный оказался гораздо менее успешным, а часто и токсичным.
Некоторые проблемы DsКрасных флуоресцентных белков были преодолены с помощью мутагенеза. Второе поколение DsКрасных, известное как DsRed2 (DsКрасный2), несёт в себе несколько мутаций в пептидно-аминном сайте терминации транскрипции, которые предотвращают формирование белковых групп и сокращают токсичность. К тому же, при этих модификациях сокращается время созревания флуророфора. Белок DsКрасный2 по-прежнему образует тетрамер, но более сочетаемый с зелёными флуоресцентными белками в экспериментах по мультиокрашиванию благодаря более быстрому созреванию. Дальнейшее сокращение времени созревания было реализовано в третьем поколении DsКрасных мутантов, которые также демонстрировали повышенную яркость по сравнению с пиком клеточной флуоресценции. Красное флуоресцентное свечение белка DsRed-Express (DsКрасный-Экспресс) наблюдается уже через час после экспрессии, в сравнении с 6 часами для DsКрасного2 и 11 часами для DsКрасного. Был также разработан вариант белка, оптимизированный для дрожжей, под названием RedStar (Красная звезда), который тоже отличается ускоренным созреванием и повышенной яркостью. Поскольку присутствие зелёного состояния в DsКрасном-Экспрессе и Красной звезде не явно, эти флуоресцентные белки являются наилучшими вариантами в оранжево-красном диапазоне в экспериментах по мультиокрашиванию. К сожалению, эти красители всегда образуют тетрамеры, поэтому они не являются самыми лучшими метками для белков.
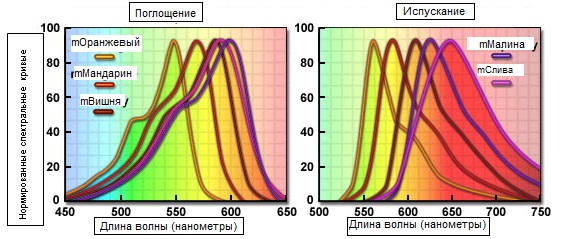
Рис. 5. Спектральные кривые оранжевых и красных мономерных флуоресцентных белков
Из организмов рифовых кораллов было выделено несколько дополнительных красных флуоресцентных белков, оказавшихся весьма перспективными. Одним из первых, применённых к клеткам млекопитающих, был HcRed1 (HcКрасный1), который был выделен из Heteractis crispa и сейчас выпускается серийно. HcКрасный1 был получен из не флуоресцирующего хромопротеина, поглощающего красный свет. В процессе мутагенеза удалось произвести слабо флуоресцирующий облигатный (обязательный) димер с максимумом поглощения на 588 нанометрах и максимумом испускания на 618 нанометрах. Хотя флуоресцентный спектр этого белка вполне отличим от спектра DsКрасного, он склонен соединятся с последним, являясь гораздо менее ярким. Для преодоления димеризации была разработана интересная конструкция из двух тандемно соединённых HcКрасных2 белков, которая могла бы служить в качестве мономерной метки. Но поскольку общая яркость двойного белка не повысилась, он не стал подходящим вариантом для стандартных приложений в микроскопии живых клеток.
Развитие мономерных вариантов флуоресцентных белков
В естественных условиях большинство флуоресцентных белков существуют в качестве димеров, тетрамеров и олигомеров более высокого порядка. Предполагается, например, что зелёный флуоресцентный белок медузы Aequorea victoria, является частью тетрамерного комплекса с экварином, правда это явление наблюдалось лишь при очень высоких концентрациях белка, и склонность флуоресцентных белков медузы образовывать димеры, в общем, очень слаба (константа диссоциации более 100 микромолей). Таким образом, при экспрессии флуоресцентных белков в тканях млекопитающих их димеризация обычно не наблюдается. Тем не менее, при нацеливании флуоресцентных белков в определённые клеточные компартменты, например, в плазматическую мембрану, местная концентрация белков, теоретически, может быть достаточна для димеризации. Это необходимо учитывать особенно при проведении FRET экспериментов, в которых сложные наборы данных могут быть испорчены артефактами вследствие димеризации.
Создание мономерных вариантов DsКрасного оказалось трудной задачей. Более 30 аминокислотных замен в структуре белка потребовалось для создания мономерного белка DsКрасный первого поколения (называемого RFP1). Однако, этот дериват демонстрировал очень слабую флуоресценцию в сравнении с исходным белком и очень быстро фотообесцвечивался, благодаря чему он был гораздо менее эффективен по сравнению с зелёными и жёлтыми флуоресцентными белками. Чтобы ослабить тенденцию потенциально эффективных биологических зондов сливаться друг с другом и сдвинуть максимумы свечения в сторону длинных волн, не прекращаются исследования по мутагенезу жёлтых, оранжевых, красных и тёмно-красных вариантов флуоресцентных белков, включая новейшие методы, например, соматичесую сверхмутацию.
Были получены мономерные флуоресцентные белки с высоким коэффициентом поглощения, квантовым выходом и фотостабильностью, хотя ни один вариант до сих пор не является оптимальным по всем критериям одновременно. В результате усилий по преодолению обязательной тетрамерности красных флуоресцентных белков, осложняющей экспрессию, были получены мономерные варианты, более приспособленные к биологическому функционированию.
Возможно самым впечатляющим достижением в этом направлении явилось создание нового поколения флуоресцентных белков, полученных из мономерного красного флуоресцентного белка путём направленного мутагенеза остатков Q66 и Y67. Белки этой группы, названные по фруктам, цвета которых совпадают с цветом флуоресценции красителей (см. таблицу 1 и рисунок 5), имеют максимум свечения в диапазоне от 560 до 610 нанометров.
Дальнейшим расширением этого класса многократной соматической сверхмутацией явились флуоресцентные белки с испусканием на длинах волн до 650 нанометров. Эти новые белки в значительной мере заполнили пробел между самыми красными флуоресцентными белками из медузы (такими как Венера) и красными флуоресцентными белками из рифовых кораллов. Хотя многим из этих новых белков не хватает яркости и стабильности, необходимых во многих экспериментах, само их существование обнадёживает и воодушевляет исследователей на создание ярких стабильных мономерных флуоресцентных белков во всём видимом диапазоне.
Оптические маркеры
Одним из наиболее интересных направлений является применение флуоресцентных белков в качестве молекулярных или оптических маркеров (см. таблицу 1), меняющих цвет или интенсивность свечения в результате внешнего светового воздействия или с течением времени. Например, в результате точечной мутации исходного пептида медузы получается фотоактивируемый вариант зелёного флуоресцентного белка (известный как PA-GFP). При облучении его светом из диапазона около 400 нанометров происходит его фотоконверсия, при которой пик возбуждения сдвигается из ультрафиолета в синий диапазон. Спектральная кривая неконвертированного PA-GFP аналогичен профилю исходного белка (с пиком возбуждения приблизительно от 395 до 400 нанометров). После фотоконверсии пик возбуждения на 488 нанометрах возрастает приблизительно в 100 раз. В результате этого возникает очень резкий контраст между неконвертированными и конвертированными пулами белков PA-GFP, что оказывается эффективным для прослеживания динамики субпопуляций молекул внутри клеток. На рисунке 6(а) представлено изображение живой трансфектированной клетки млекопитающего до фотоконверсии белков PA-GFP, находящихся в её цитоплазме и возбуждаемых аргоновым ионным лазером на 488 нанометрах. Изображение той же клетки, но уже после фотоконверсии PA-GFP, осуществлённой синим диодным лазером на длине 405 нанометров, представлено на рисунке 6(d).
Табл. 1. Свойства отдельных оптических маркеров
|
Белок (акроним)
|
Максимум возбуждение
(нм)
|
Максимум испускание
(нм)
|
Коэффициент молярной экстинкции
|
Квантовый выход
|
Структура in vivo
|
Относительная яркость (%отEGFP)
|
|
PA-GFP
|
504
|
517
|
17,400
|
0.79
|
Мономер
|
41
|
|
CoralHue Kaede (G)
|
508
|
518
|
98,800
|
0.88
|
Тетрамер
|
259
|
|
CoralHue Kaede (R)
|
572
|
580
|
60,400
|
0.33
|
Тетрамер
|
59
|
|
CoralHue Dronpa (G)
|
503
|
518
|
95,000
|
0.85
|
Мономер
|
240
|
|
Kindling (KFP1)
|
580
|
600
|
59,000
|
0.07
|
Тетрамер
|
12
|
|
PS-CFP (C)
|
402
|
468
|
34,000
|
0.16
|
Мономер
|
16
|
|
PS-CFP (G)
|
490
|
511
|
27,000
|
0.19
|
Мономер
|
15
|
|
mEosFP (G)
|
505
|
516
|
67,200
|
0.64
|
Мономер
|
128
|
|
mEosFP (O)
|
569
|
581
|
37,000
|
0.62
|
Мономер
|
68
|
Другие флуоресцентные белки также могут использоваться в качестве оптических маркеров. Трёхфотонным возбуждением (на длине волны не более 760 нанометров) флуоресцентного белка DsКрасного его красное свечение можно конвертировать в зелёное. Этот эффект связан, вероятно, с избирательным фотообесцвечиванием красных хромофоров в DsКрасном, благодаря чему становится заметной флуоресценция в зелёном состоянии. Вариант DsКрасного, называемый Таймером (Timer) постепенно, в течение нескольких часов, меняет своё свечение с ярко зелёного (500 нанометров) на ярко красное (580 нанометров). Соотношение зелёной и красной флуоресценции может быть использовано для сбора временны?х данных в исследованиях экспрессии генов.
Фотопереключаемый оптический маркер PS-CFP получен мутагенезом варианта зелёного флуоресцентного белка. При освещении этого белка на 405 нанометрах его флуоресценция меняется с голубой на зелёную (этот вид фотоконверсии представлен на рисунках 6 (b) и (e)). Будучи мономером, этот зонд может быть особенно эффективен при изучении фотообесцвечивания, фотоконверсии и фотоактивации. Однако, яркость свечения PS-CFP примерно в 2,5 раза ниже, чем у PA-GFP, и, по сравнению с другими маркерами, его фотоконвертируемость не так высока (40-нанометровый сдвиг флуоресценции при фотоконверсии меньше, чем наблюдаемый у аналогичных красителей). Дополнительный мутагенез этого или «родственных» ему флуоресцентных белков, возможно, приведёт к более эффективным вариантам в этом спектральном диапазоне.
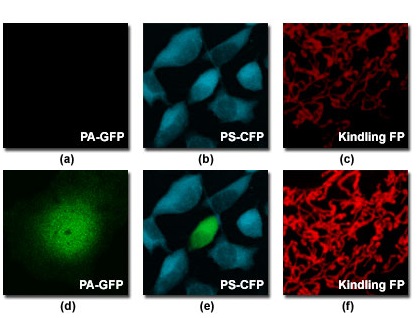
Рис. 6. Флуоресцентные белки-маркеры
Оптические маркеры были также получены из флуоресцентных белков, клонированных из кораллов и актиний. Флуоресцентный белок Kaede, выделенный из мадрепорового (каменистого) коралла, в ультрафиолетовом свете фотоконвертируется из зелёного в красный. В отличии от PA-GFP, конверсия флуоресценции белка Kaede возникает при поглощении света, спектрально отличного от того, на котором происходит возбуждение. К сожалению, этот белок является облигатным тетрамером, что делает его менее удобным в качестве метки антигенной детерминанты, по сравнению с PA-GFP. Другой тетрамерный вариант флуоресцентного белка мадрепорового коралла (Lobophyllia hemprichii), называемый EosFP (см. таблицу 2), при облучении ультрафиолетом приблизительно на 390 нанометрах меняет ярко зелёную флуоресценцию на оранжево-красную. В этом случае спектральный сдвиг происходит в результате фотоиндуцированной модификации, заключающейся в разрыве полипептидного остова, прилегающего к хромофору. В результате дальнейшего мутагенеза «дикого» белка EosFP были получены мономерные дериваты, которые могут оказаться полезными в создании гибридных белков.
Третьим оптическим маркером, полученным не из Aequorea, является разжигаемый (Kindling) флуоресцентный белок (KFP1), созданный на основе нефлуоресцентного хромопротеина, выделенного из Anemonia sulcata (сейчас он серийно выпускается фирмой «Евроген»). Разжигаемый флуоресцентный белок не светится, пока не облучён зелёным светом. Свет низкой интенсивности вызывает кратковременное красное свечение, которое затухает через несколько минут (см. митохондрии на рисунке 6©). Облучение синим светом немедленно тушит «разожжённую» флуоресценцию, позволяя тем самым надёжно контролировать флуоресцентное окрашивание. И напротив, высоко интенсивное освещение вызывает необратимое разжигание, приводящее к стабильной подсветке (окрашиванию), подобно белку PA-GFP (рисунок 6(f)). Возможность точного управления флуоресценцией особенно важна при слежении за движением частиц в плотном окружении. Этот метод, например, позволяет проследить развитие клеток нервной пластинки эмбриона Xenopus (шпорцевой лягушки) и движение отдельных митохондрий в клетках PC12.
Развитие оптических маркеров продолжается, и оно идёт в направлении создания эффективных для молекулярного маркирования флуоресцентных белков, их более ярких мономерных вариантов, легко фотоковертируемых и представляющих широкий спектр цветов. Эти достижения, а также микроскопы, оснащённые оборудованием, позволяющем гармонично сочетать режимы освещения для наблюдения флуоресценции и направленную маркировку, станут обычными для биологических лабораторий в не столь отдалённом будущем. В конце концов, эти инновации способны привести к важным достижениям в исследовании пространственно-временной динамики систем сигнальной трансдукции.
Векторы флуоресцентных белков и перенос генов
Флуоресцентные белки достаточно универсальны и успешно применяются почти во всех биологических дисциплинах от микробиологии до системной физиологии. Эти красители уже стали повсеместными и успешно применяются в качестве репортерных молекул в изучении экспрессии генов в культивируемых клетках и тканях и живых организмах. В живых клетках флуоресцентные белки обычно используются для наблюдения местоположения и динамики белков, органелл и других клеточных компартментов. Было разработано много различных методик для гибридизации флуоресцентных белков и усиления их экспрессии в клетках млекопитающих и других системах. Основным средством доставки химерных генетических последовательностей флуоресцентных белков в клетки являются бактериальные плазмиды и вирусные векторы, полученные методами генной инженерии.
Гены флуоресцентных белков могут быть введены в клетки млекопитающих и другие клетки с помощью соответствующих временных или стабильных векторов (обычно это плазмиды или вирусы). В экспериментах по временной экспрессии генов (часто называемых врeменной трансфекцией) ДНК плазмид или вирусов, введённых в организм-хозяин, не обязательно сливаются с хромосомами, но могут экспрессироваться в цитоплазме в течении короткого периода времени. Экспрессия слитых (гибридных) генов, легко отслеживаемая по флуоресцентному свечению с помощью фильтрационных блоков, соответствующих данному флуоресцентному белку, начинается в течении нескольких часов после трансфекции и продолжается от 72 до 96 часов после введения ДНК плазмид в клетки млекопитающих. Во многих случаях ДНК плазмид могут быть введены в геном устойчивым образом, что порождает стабильные трансформированные клеточные линии. Выбор между временной и стабильной трансфекцией зависит от объектов-мишеней в данном эксперименте.
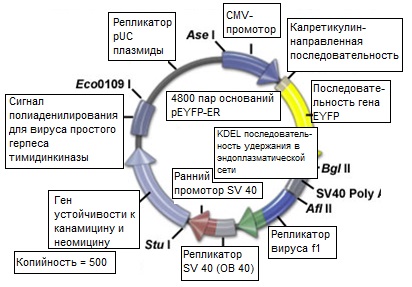
Рис. 7. Рестрикционный фермент и генетическая карта серийно выпускаемого деривата бактериальной плазмиды
Базовая конфигурация плазмидного вектора, способного обеспечить перенос генов флуоресцентного белка, имеет несколько необходимых компонентов. Плазмиды должны содержать нуклеотидные последовательности прокариотной клетки, кодирующие начало репликации ДНК в бактерии, и ген устойчивости к антибиотику. Эти элементы, часто называемые челночными последовательностями, обеспечивают размножение и отбор плазмид в бактерии-хозяине для производства необходимого количества векторов для трансфекции в клетки млекопитающих. В дополнение, плазмиды должны содержать один или несколько эукариотических генетических элементов для управления началом транскрипции информационной РНК, сигнал полиаденилирования в клетках млекопитающих, интрон (необязательно) и ген для ко-селекции в клетках млекопитающих. Транскрипционные элементы необходимы для экспрессии представляющего интерес гибридного белка в клетке-хозяине млекопитающего, а селективным геном обычно является антибиотик, обеспечивающий устойчивость содержащих плазмиды клеток. Эти общие условия могут меняться в зависимости от назначения плазмид, и многие векторы имеют широкий спектр дополнительных компонентов, необходимых для конкретных приложений.
На рисунке 7 представлен рестрикционный фермент и генетическая карта серийно выпускаемого (БД Биосайенсис Клонтек) деривата бактериальной плазмиды, содержащей кодирующую последовательность усиленного жёлтого флуоресцентного белка, слитого с последовательностью выступающего в качестве мишени калретикулина (резидентного белка) эндоплазматической сети. В результате экспрессии этого генного продукта в восприимчивых клетках млекопитающих возникает содержащий EYFP химерный пептид, локализованный в мембране эндоплазматической сети и специально разработанный для флуоресцентного окрашивания этой органеллы. Вектор-хозяин является дериватом высококопийной плазмиды pUC (приблизительно 500 копий), содержащей бактериальный репликатор, обеспечивающий размножение специальных штаммов E. сoli. Ген антибиотика канамицина, экспрессированный в бактерии, сообщает ей устойчивость в качестве селективного маркера.
Вектор EYFP, представленный выше, дополнительно содержит промотор цитомегаловируса (CMV) человека для обеспечения экспрессии генов в линии трансфектированных клеток человека и млекопитающих, а также репликатор бактериофага f1 для производства однонитевых ДНК. Векторный остов также включает в себя репликатор обезьяньего вируса (ОВ-40), активного в клетках млекопитающих, которые экспрессируют Т-антиген вируса ОВ-40. Селекция устойчивых к антибиотику G418 трансфектантов обеспечивается кассетой, кодирующей резистентность к неомицину и состоящей из раннего промотора ОВ-40, гена устойчивости к неомицину (аминогликозид 3'-фосфотрансферазы) и сигналов полиаденилирования для вируса простого герпеса тимидинкиназы (ТК ВПГ) для стабильности мРНК. Для большей степени универсальности плазмиды в её остове (см. рисунок 7) присутствуют шесть уникальных рестрикционных ферментов.
Размножение, выделение и трансфекция плазмид флуоресцентных белков
Успешная трансфекция в клетках млекопитающих зависит от того, насколько чистыми и свободными от бактериальных эндотоксинов будут применяемые в эксперименте плазмидные или вирусные векторы. В нативном состоянии молекула кольцевой плазмидной ДНК представляет собой третичную сверхспиральную структуру, в которой двойная спираль закручена вокруг себя несколько раз. В течение лет методом очистки сверхспиральных плазмидных и вирусных ДНК было центрифугирование в градиенте плотности хлористого цезия в присутствии интеркалирующего агента (например, бромистого этидия или йодида пропидия). Этим методом, затратным с точки зрения как оборудования, так и материалов, сверхспиральная (плазмидная) ДНК разделяется на линейную хромосомную и разорванную кольцевую ДНК в соответствии с плавучей плотностью, позволяя собирать плазмидные ДНК высокой степени очистки. Недавно, этот громоздкая и долгая процедура центрифугирования была заменена упрощённым методом ионообменной хроматографии (обычно называемым mini-prep), позволяющим получать свободные от эндотоксинов плазмидные ДНК относительно быстро и в больших количествах.
Специальные бактериальные мутанты, называемые компетентными клетками, были разработаны для удобного и относительно недорогого умножения плазмидных векторов. Благодаря набору специальных мутаций эти бактерии особенно восприимчивы к репликации плазмид, а химически нарушенная проницаемость их мембраны обеспечивает перенос (называемый трансформацией) ДНК через саму мембрану и клеточную оболочку. После трансформации бактерии выращиваются до логарифмической фазы в присутствии антибиотика, с помощью которого осуществляется отбор, управляемый плазмидами с кодом этого антибиотика. Бактериальная культура уплотняется центрифугированием и лизируется раствором щелочного моющего средства, содержащего ферменты для очистки от РНК. После этого лизат фильтруется и помещается на ионообменную колонку. Нежелательные компоненты, включая РНК, ДНК и белки, тщательно вымываются из колонки перед тем, как ДНК плазмид извлекаются с помощью высокосолевого буфера. После этого извлечённые ДНК плазмид осаждаются в спиртовом растворе (изопропаноле), собираются центрифугированием, промываются и опять растворяются в буфере. Очищенные таким образом ДНК готовы для экспериментов по трансфекции.
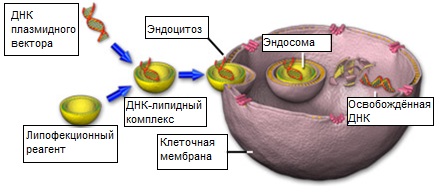
Рис. 8. Липидная трансфекция в клетки млекопитающих
Клетки млекопитающих, используемые для трансфекции, должны быть в превосходном физиологическом состоянии и находиться в логарифмической фазе роста. Для оптимизации внедрения плазмидных ДНК в культивируемые клетки были разработаны многочисленные трансфекционные реагенты, выпускаемые сегодня серийно. Методики внедрения разнообразны: от простого осаждения фосфатом кальция до связывания плазмидных ДНК липосомами, которые проникая сквозь клеточную мембрану, доставляют содержимое в цитоплазму (как показано на рисунке 8). Обобщённо называемые липофекцией, методы с использованием липидов получили широкое распространение благодаря своей эффективности для большого количества популярных клеточных линий и применяются сегодня в большинстве экспериментов по трансфекции.
При врeменной трансфекции потеря плазмидного гена происходит обычно в течение относительно короткого периода (несколько дней), в то время как стабильные линии трансфектированных клеток вырабатывают «гостевые» белки достаточно долго (от нескольких месяцев до нескольких лет). Стабильные клеточные линии могут отбираться с помощью антибиотических маркеров в плазмидном остове (см. рисунок7). Одним из наиболее распространённых антибиотиков для селекции стабильных трансфектантов в линиях клеток млекопитающих является лекарственный препарат G418, подавляющий синтез белков, не его доза значительно меняется в зависимости от клеточной линии. Для селекции стабильных клеток были разработаны и другие часто применяемые антибиотики, включая гидромицин B и пуромицин, которые тоже имеют генетические маркеры. Эффективность получения стабильных клеточных линий определяется эффективностью начальной трансфекции. Электропорация, в этом отношении, оказалась надёжным способом получения стабильных трансфектантов линеаризованными плазмидами и очищенными генами. Метод электропорации заключается в пропускании коротких импульсов высокого напряжения через клеточную суспензию, в результате чего в плазматических мембранах образуются поры, через которые трансфекционные ДНК попадают в клетки. Процедура электропорации требует специального оборудования, тем не менее, его стоимость сравнима с затратами на липофекционные реагенты при выполнении большого числа трансфекций.
Будущее флуоресцентных белков
Современное развитие флуоресцентных белков идёт по двум основным направлениям. Первое — окончательная «доводка» существующей палитры (от синих до жёлтых) флуоресцентных белков, полученных из медузы Aequorea victoria, а второе — усовершенствование мономерных флуоресцентных белков, испускающих в видимом диапазоне от оранжевого до дальнего красного. Прогресс, достигнутый в этих направлениях, действительно впечатляет, и появление на горизонте ближних инфракрасных флуоресцентных белков уже не кажется невообразимым.
Последнее поколение белков, выделенных из медузы, во многом восполнило дефицит первых флуоресцентных белков, особенно жёлтых и зелёных дериватов. Поиск мономерного, яркого и быстро созревающего красного флуоресцентного белка привёл к нескольким новым и интересным классам флуоресцентных белков, особенно тех, которые были выделены из кораллов. Дальнейшее расширение цветовой палитры происходит как за счёт развития существующих флуоресцентных белков, так и благодаря новым технологиям, например, внедрению искусственных аминокислот. А поскольку оптические методы спектрального разделения продолжают развиваться и становятся более распространёнными, эти новые варианты обязательно дополнят существующую палитру, особенно в жёлтом и красном участках спектра.
Сегодня в технологии флуоресцентных зондов имеет место тенденция к повышению роли красителей, флуоресцирующих в дальнем красном и ближнем инфракрасном. В клетках млекопитающих и автофлуоресценция, и поглощение света резко сокращаются на красном конце спектра. Таким образом, развитие дальних красных флуоресцентных красителей будет чрезвычайно полезным для исследования толстых образцов и животных целиком. В случае успешного использования флуоресцентных белков в качестве репортерных молекул в трансгенных системах, применение красных флуоресцентных белков в целых организмах станет в ближайшие годы чрезвычайно важным.
Наконец, только сейчас начинает осознваться огромный потенциал приложения флуоресцентных белков для создания биосенсоров. Количество различных биосенсоров стремительно растёт. Использование структурной информации приводит к постоянному повышению их чувствительности. Успехи в этом направлении вселяют уверенность в том, что почти любой биологический параметр можно будет измерить биосенсором на базе соответствующего флуоресцентного белка.






.png)